
Od Lorenzova oleje k léčebným genům
Nejslavnějším pacientem s adrenoleukodystrofií se stal Američan Lorenzo Odone, jehož rodiče se nehodlali smířit s omezenými možnostmí léčby a iniciovali výzkum, který vedl k vývoji zvláštní směsi olejů. Konzumace tzv. Lorenzova oleje pomáhá oddálit nástup choroby a snad i zmírnit její průběh.
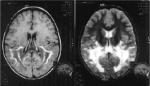
Obětem adrenoleukodystrofie může pomoci transplantace kostní dřeně. Buňky imunitního systém pocházející od zdravého dárce pronikají až do mozku, přispívají tam k normalizaci poměrů a chrání nervovou tkáň před největšími škodami. Často však není pro nemocného vhodný dárce k dispozici. Vyhráno není, ani když se dárce najde. Pacientům s adrenoleukodystrofií hrozí při transplantaci velké riziko.
Mezinárodní tým genetiků a lékařů pod vedením Patricka Aubourga z pařížského výzkumného centra INSERM použil k léčbě dvou chlapců s adrenoleukodystrofií revoluční metodu. Genetici nasadili proti chorobě virus HIV v roli „trojského koně“. Vybrali z viru jeho vlastní geny a místo nich „podstrčili“ lidský gen ABCD1, který mají pacienti s adrenoleukodystrofií poškozený. Dvěma chlapcům, u kterých se začaly projevovat první příznaky onemocnění odebrali buňky kostní dřeně a v laboratoři je vystavili účinku pozměněného viru HIV. Virus pronikl do buněk a zabudoval tam dědičnou informaci ze svého nitra. Tak se dostala do buněk pacientů nepoškozená kopie genu ABCD1.
Poté byli oba chlapci ozařováním zbaveni vlastní kostní dřeně a absolvovali transplantaci buněk s „opravenou“ dědičnou informací. Zákrok se zdařil. U obou chlapců se obnovila krvetvorba a 15% nově vznikajících krvinek mělo dědičnou informaci zbavenou defektu. Tyto buňky putovaly do mozku obou nemocných a chránily jej před devastací.
Od náročného zákroku uplynuly více než dva roky a chlapci zatím netrpí žádnými zdravotními problémy, jež by bylo možné připsat na vrub nežádoucích vedlejších účinků léčby. Postup choroby se dramaticky zpomalil. Zcela zastavit se jej však nepodařilo. Zprávu o úspěchu Aubourgova týmu přinesl prestižní vědecký týdeník Science.
Virus HIV je poslední z dlouhé řady virů, které lékaři využili k léčbě dědičných onemocnění. Předchozí viry měly celou řadu nectností. Některé vnášejí ozdravné geny jen do dělících se buněk, jiné jsou obtížně přijatelné pro imunitní obranu nemocného. Některé viry zabudovávají opravný gen do blízkosti jiných genů. Hrozí, že tím změní funkci těchto genů a buňky nabudí k nádorovému bujení. Nová metoda léčby pomoci upraveného viru HIV by měla být účinnější a bezpečnější.
„Je to skutečný průlom,“ ohodnotil výsledky Aubourgova týmu odborník na genovou terapii Mark Kay z kalifornské Stanford University v rozhovoru pro vědecký týdeník Nature.
Mastné kyseliny poškozují mozek
Osud dětí postižených dědičnou adrenoleukodystrofií bývá neradostný. Poškození genu ABCD1 naruší metabolismus tuků v buňkách. V těle nemocných se hromadí velké množství mastných kyselin s dlouhým řetězcem. Ne zcela jasným mechanismem narušují vysoké hladiny těchto mastných kyselin práci buněk v mozku, především, tzv. mikroglií a oligodendrocytů. Buňky neprodukují dostatek myelinu, který obaluje nervové výběžky, jimiž putují vzruchy mezi neurony. Výběžky se pak chovají jako elektrický vodič se zničenou izolací. Nedokážou už přenášet nervové vzruchy.
Gen ABCD1 se nachází na pohlavním chromozomu X. To je důvod, proč ženy touto chorobou netrpí. Nesou v dědičné informaci dva chromozomy X a defekt genu ABCD1 na jednom chromozomu je u nich kompenzován „zdravým“ genem na druhém pohlavním chromozomu. Pokud zdědí chlapec od matky s chromozomem X poškozený gen ABCD1, ocitá se v přímém ohrožení, protože otec mu předá mužský pohlavní chromozom Y, kde se gen ABCD1 nenachází. Chlapci mají jediný gen ABCD1 a v případě jeho poškození nemají k dispozici náhrada. Tímto postižením trpí jeden z 50 000 narozených chlapců.
Při nejtěžší formě onemocnění je těžce zasažen mozek. První příznaky bývají patrné už ve věku 6 až 8 let. Obvykle se projeví hyperaktivitou, zhoršením školního prospěchu, poruchami sluchu a zraku. Později se připojí epileptické křeče. Do dvou let se rozvine u nemocného dítěte těžká duševní demence, dochází k ochrnutí, potížím s dýcháním a polykáním. Pacienti často umírají na komplikace, které jsou vedlejším důsledkem onemocnění. Lorenzo Odone měl těžce narušené polykání a zemřel ve věku třiceti let na zápal plic způsobený vdechnutou potravou.
Nový způsob léčby pomocí upraveného viru HIV je příslibem pro boj s celou řadou dalších dědičných onemocnění. Předtím ale bude nutné zvýšit účinnost procedury. „Oprava“ genu u 15% buněk by pro léčbu jiných dědičných defektů zřejmě nestačila.
Vzlety a pády léčby genem
Genová terapie má za sebou období úspěchů i těžké porážky. Poprvé provedl opravu dědičného defektu v těle pacienta americký lékař William French Anderson v roce 1990. Jeho pacientka Ashanti da Silvaová trpěla dědičnou poruchou imunitního systému. Buňky kostní dřeně s opravenou dědičnou vadou pomohly spolu s další léčbou tehdy čtyřleté Ashanti k uzdravení.
Po úspěchu Frenche Andersona se ke genové terapii začaly upírat naděje lékařů i nemocných a jejich blízkých. Před deseti lety narazily jejich sny o brzkém masovém uplatnění genové terapie na tvrdou realitu. Osmnáctiletý Jesse Gelsinger se jako dobrovolník podrobil na University of Pennsylvania testům bezpečnosti viru, který chtěli lékaři využít pro léčbu dědičného defektu jater. Sedmnáct dobrovolníků absolvovalo test bez nejmenších problémů. U Gelsingera došlo k nečekané reakci. Virus jeho organismus doslova zaplavil a způsobil selhání orgánů. Po několikadenním boji Jesse Gelsiger zemřel. Vyšetřování odhalilo nesrovnalosti při organizaci testů. Svou roli sehrála i náhoda. Gelsinger se zřejmě už někdy nakazil podobným virem, jaký chtěli genetici využít pro léčbu, a jeho tělo reagovalo na opětovný střet šokem.
„Nechali jsme se strhnout jednoduchostí koncepce genové léčby. Zdálo se, že stačí jen dodat potřebný gen,“ vzpomínal vedoucí tragického experimentu James Wilson v rozhovoru pro časopis Scientific American. „Kdybych tenkrát věděl to, co vím o genové terapii dnes, nikdy bych se do těch testů nepustil.“
Na lepší časy se blýsklo v genové terapii v roce 2000, kdy francouzský tým pod vedením Alaina Fischera vyléčil dvě desítky takzvaných „bublinových dětí“. V důsledku defektu jednoho genu se tyto děti rodí s nefunkčním imunitním systémem. Na životě je ohrožují i banální infekce. Fischerovi pacienti mohli po opravě genu v kostní dřeni opustit sterilní prostředí a žít normálním životem. Záhy se ale ukázalo, že v několika případech narušilo zabudování ozdravného genu funkci dalších genů buněk kostní dřeně. Několik dětí onemocnělo leukémií a genová léčba „bublinových dětí“ byla počátkem roku 2003 zastavena. Znovu se rozběhla až v roce 2005, kdy se lékařům a genetikům podařilo eliminovat největší rizika.
Alain Fischer se podílel i na léčbě obou hochů s adrenoleukodystrofií. Tentokrát se zdá, že je vše v pořádku. Vědci nepozorují, že by se některé bílé krvinky množily rychlejším tempem a signalizovaly tak nástup leukémie.
„Leukémie je to nejhorší, co by mohlo naše pacienty postihnout,“ přiznal Patrick Aubourg v rozhovoru pro Nature. „Pacienty však i po třech letech dále sledujeme a zatím jsme s jejich zdravotním stavem celkem spokojení.“
Snad se tedy v genové terapii opět blýsklo na lepší časy. To je dobrá zpráva nejen pro pacienty s dědičnými chorobami. Genová terapie slibuje léčbu i mnohem běžnějších nemocí, jako je například rakovina, kardiovaskulární onemocnění či Parkinsonova choroba.
„Lék pro Lorenza“
Vědci vzkřísili rozsivku po 7 tisících let v sedimentu na dně Baltu
Autor: Stanislav Mihulka (02.04.2025)
Naegleriavirus je nemesis nelítostného zabijáka naeglerie
Autor: Stanislav Mihulka (29.04.2024)
Zombie článek: Biofilm z mrtvých bakterií skvěle těží elektřinu z potu
Autor: Stanislav Mihulka (09.08.2022)
Doba izolace 5 dnů pozbývá s omikronem smysluplnost
Autor: Josef Pazdera (15.01.2022)
Přelom roku v novinkách covid-19
Autor: Josef Pazdera (04.01.2022)
Diskuze:
pak je ovsem lecba sporna
Zdena Galajdova1,2010-01-20 15:48:45
pak je ovsem vhodnost lecby velmi sporna, protoze v zajmu jedince se ohrozi dalsi jedinci a vznika moznost, ze se akcni radius nemoci znacne rozsiri - jinymi slovy lecka je sice mozna, ale sobecka a zrudna co do prognozy lidstva. Mylim se nebo ne ?
Další pokus o čistou rasu?
Miroslav Stuchlík,2010-01-20 22:49:25
Půjdete ty nemocné kluky taky vystřílelet? Nebo je necháte roky pomalu chcípat bez pomoci?
Barak Obava,2010-01-21 10:05:30
Není potřeba je střílet, dokonce i kastrace je zbytečná. Vasektomie s předchozím zamrazením spermatu je naprosto dostačující. V budoucnu po oplodnění vajíčka pak provést preimplantační genovou analýzu a vybrat ta, která jsou v pořádku. Dá se předpokládat, že "opravené" geny budou i v odpovídajícím procentu spermií.
léčba
Jaroslav Petr,2010-01-20 13:20:56
Je mi líto, ale to nelze. Tzv. germ line gene therapy je zakázána mezinárodními konvencemi. Další alternativou je kastrace.
Léčba
Barak Obava,2010-01-20 10:18:16
Snaha o léčbu postižených chlapců je jistě chvályhodná, nicméně by měla jít ruku v ruce se zajištěním toho, že nebudou svůj defektní gen dále šířit, protože pak by se stalo to, co se dosud stát nemohlo - totiž že se nám tu objeví děvčata, která budou mít defektní obě kopie genu.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce





