
Výsledky studie vyšly v Science Immunol. minulý pátek. První podepsanou osobou je Yanqi Ye. Podařilo se nám zjistit, že jde o ženu. U dalších spoluautorů si už tak jisti nejsme: Xudong Zhang, Quanyin Hu, Yuqi Zhang, Qi Liu, Di Wen, Leaf Huang, Zhen Gu,... I když to tak nevypadá, ve všech případech jde o zaměstnance čtyř oddělení a ústavů spadajících pod Univerzitu Severní Karolíny v Chapel Hill. Novým poznatkem se tedy honosí a prestiž si vylepšuje americká instituce. O co v něm jde? O ucelenou léčbu zahrnující jak přípravu imunizační látky, tak i speciální způsob jejího podání, a v něm nejspíš tkví tajemství úspěchu.
Co je melanom?
Melanom je nádorové onemocnění, jehož incidence v celém světě rychle roste. V USA se počet případů za dvě desetiletí ztrojnásobil. V Česku si verdikt: „máte zhoubný melanom“ vyslechne ročně dva tisíce nešťastníků. Polovina nemocných má mutaci v genu BRAF a jejich tumor nereaguje na chemoterapii. Melanom postihuje především bílou populaci. Bohužel, veškerému pokroku v medicíně navzdory u melanomu s metastázemi už zhruba třicet let platí, že pravděpodobnost celkového přežití se až příliš často počítá jen v měsících. Melanom je typ rakoviny, který začíná v pigmentových buňkách zvaných melanocyty. Ty nejsou jen v kůži, jak se většina z nás domnívá, ale i v očích, střevech,... A i když se traduje, že melanom je rakovina kůže, může vzniknout i jinde. I když nepatří mezi časté rakoviny (uvádí se, že tvoří asi pět procent nádorů), vynahrazuje si to svou agresivitou. Uvádí se, že jen jeden pacient ze čtyř žije od stanovení diagnózy déle než rok.
Jednou z nadějí pro ty, kteří už mají metastázující melanom, je léčba zaměřená na protein nazývaný PD-1. Ten je součástí membrány řady buněk, ale nemocným s melanomem ku prospěchu není. S jeho přičiněním se zhoubným buňkám daří našemu imunitnímu systému unikat. Abychom pochopili, komu se tento přirozeně se vyskytující protein stane přítěží, je potřeba začít až v našem útlém mládí. Je to k nevíře, ale už krátce po početí v nás začne řádit smrt. Po narození už v nás umírá dvacet až třicet miliard buněk denně. V dospělosti to stoupá na 50 až 70 miliard buněk. Všechny tyto případy lze připsat na vrub řízené buněčné smrti. Buňkám ji ordinuje kaskáda enzymatických dějů a tomuto procesu odborníci říkají apoptóza. Když ta selže, máme co do činění s rakovinou.

Plánovaná smrt je tedy důležitou součástí života a chrání nás od té neplánované. Zmíněný protein PD-1 je zkrácenina anglického „programmed cell death protein 1”. V překladu to znamená, že jde o protein, který v programované buněčné smrti hraje první housle. I když se o něm mluví jako o proteinu buněčné membrány, má dlouhé prsty. A nebo spíš by se hodilo říkat ocásek. Z povrchu membrány, kde slouží jako anténa (receptor), sahá až do cytoplazmy. Podle pokynů z vnějšku zprostředkovává uvnitř buňky řadu dějů, včetně naordinování zmíněné buněčné smrti. A v tom je ten zakopaný pes. U agresivního melanomu se proteinu PD-1 na našich bílých krvinkách, zvaných T buňky, tvoří hodně, a ten utlumí jejich množení. Nejen to, zvýší se u nich i četnost spouštění buněčné smrti. Tím ale počet našich obránců v krvi klesá, a klesá tedy i naše odolnost vůči rakovině. To je ten případ, kdy je nám aktivace proteinu PD-1 ku škodě.
Na zmíněný protein se zaměřují nové léky. Tvoří je protilátka, která je připravena tak, aby se navázala na receptor molekuly PD-1. Tím, že ho „obalí“, ho vyřadí ze hry. V příbalovém letáku mají takové léky slovo blokátor. Jejich použití v humánní medicíně je již schváleno (příkladem je lék Keytruda). Proč se o tomto úspěchu imunologů, který není předmětem nového objevu, o němž hodláme psát, zmiňujeme? Protože u většiny pacientů tzv. neodpovídačů (jejich počet se uvádí mezi 60 – 80 %) nezabírá.
Nynější novinka v léčbě melanomu se liší od uvedené a o něco starší novinky prakticky ve všem. Pravdou je, že výsledky se týkají jen myší a léčba na lidech zatím odzkoušena nebyla. To ale odborníkům nevadí, protože úspěch na hlodavcích s rakovinovým buněčným kmenem B16-F10 by měl dávat dostatečnou záruku, že metoda bude zabírat i u melanomu primátů.
Zatímco většina pracovišť se honí za úzce směrovanou léčbou a za přípravky zaměřenými na specifické receptory, nová metoda si na nějaké jednotlivosti ani na čištění přípravku nehraje. Léčba spočívá v humpoláckém podání něčeho, na co dobře sedí laický termín „rozšmelcované nádorové buňky“. Prakticky se tak pokus metodologicky vrací do doby začátků imunogentiky, někdy před čtyřiceti lety. Výzkumnickému týmu muselo být rovněž známo, že hodně podobné pokusničení na myších před časem prováděli jejich kolegové, onkologové v nemocnici Svatého Jiří v Londýně a že to s účinností jejich autologní vakcíny nedopadlo dobře.
Jak to, že Američané nyní hlásí úspěch?
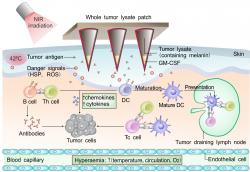
Zdá se, že tajemství úspěchu tkví ve způsobu podání vakcinační dávky. Na její přípravě se totiž nic zajímavého neudálo. Jak jsme již sarkasticky naznačili, s její přípravou si tentokrát výzkumníci hlavu moc nelámali. Jednoduše vzali buňky nádoru a jen je mechanicky rozrušily. Jak sami říkají, „udělali jsme z nádoru pyré“. To další už je zajímavější. Pyré z nádoru zapracovali do mikrojehel. Stovek mikrojehliček, které se jako náplast přitlačí na kůži. Takové řešení vykázalo řadu výhod. Dopravilo imunizační dávku těsně pod kůži a tedy do míst, kde bílé krvinky tvoří první linii obrany. Z hlediska vyprovokování odezvy je taková aplikace účinnější, než když se látka píchne kamkoli jinam. Navíc je „vetřelec“ najednou na mnoha místech – jehliček jsou stovky a tím se vpravovaný antigen dostává k řadě typů bílých krvinek současně. To jim usnadní komunikaci a spolupráci.
První autorka Ye, je imunoložkou, ale chytře se spojila s experty na polymery. Ti vyrobili mikrojehly na bázi polymerované kyseliny hyaluronové, aby se hroty rozpouštěly pomalu a dávkovaly mikronizovanou imunizační látku postupně. To imunitní systém také nemá rád. Ani to ale ještě není vše. Výzkumníky ještě napadlo přidat ozařování. Nikoli to, které teď asi máte na mysli a kterým se nádorové buňky usmrcují. Naopak. Do místa léčby přisvicovali světlem zcela neškodným (blízkým infračervenému spektru). I to mělo důvod. Imunizační suspenzi připravovali z nádoru melanomu, a to znamená, že v imunizační dávce bylo poměrně dost melaninu. Ale nebylo ho dost k jejich záměru.

Melanin je přirozený pigment a imunitní systém ho nevnímá jako hrozbu. Jeho molekuly ale mají schopnost efektivně přeměňovat absorbovanou energii slunečního svitu na teplo. Do imunizační dávky proto přidali ještě něco melaninu navíc. Když pak na místo vakcinace posvítili laserem, tak v něm zvýšili teplotu (na 42 stupňů Celsia). Vytvořili tím jakousi lokální horečku. Ta na imunitní buňky působí jako magnet. Dendritickým buňkám to usnadnilo rozhodování, zda mají zakročit (provést vazbu na antigen) a prezentovat ho jako „zloducha“ dalším specializovaným účastníkům lymfocytární sešlosti. Správně informovaná společnost se dokáže bránit jak tvorbou protilátek, tak bojem kontaktním.

Závěr
Řadou drobných vylepšení imunizace se podařilo imunitní systém přimět k tomu, aby začal reagovat i na mírnou provokaci melanomu, která by ho jinak nechala chladným. Parta ze Severní Karolíny se tak může začít chlubit něčím, co se zatím nikomu nepodařilo. Zatímco u neimunizovaných myší v kontrole melanom roste tak rychle, že všechny musejí být utraceny nejpozději do 25. dne, z těch imunizovaných v pokusu jich 87 % implantovaný nádor odhojilo zcela a myši přežívaly dlouhodobě. Zbylé vykazovaly zmenšení primárního nádoru a zpomalení růstu metastáz.
Takové výsledky jsou pádným důvodem jak k oslavě, tak i bezodkladnému zahájení klinických studií.
Literatura
Y. Ye el al., "A melanin-mediated cancer immunotherapy patch," Science Immunology, 10 Nov 2017:Vol. 2, Issue 17, eaan5692 DOI: 10.1126/sciimmunol.aan5692
North Carolina State University