I když regenerační a transplantační medicína v případě orgánů jakými jsou ledviny, játra, plíce a srdce ušla už velký kus cesty, u smyslových orgánů stále přešlapuje na místě. U zraku to nejdál dotáhli na Tufts University na severovýchodě USA. Z drápatky, respektive jejích pulců, tam připravili model, který by se mohl stát odrazovým můstkem pro budoucí přelomovou léčbu zraku. A vlastně i lepších výsledků při transplantacích prakticky čehokoliv.

U přenosu smyslových orgánů je jeden velký problém. Tím je obnovení inervace a komunikace s mozkovým centrem. Platí to jak pro zrak a sluch, tak i čich a hmat. Ke svému pokusničení si v Medfordu vybrali žabku Xenopus laevis. Tato původem Afričanka, je dnes rozlezlá a snadno dostupná po celém světě. Zasloužil se o to chovatelský boom ve třicátých letech minulého století. Tehdy bylo zvykem mít doma akvárium. V něm, kromě exotických rybek a želv, se zvláštní přízni těšily žabky. O koutky exotické fauny se tehdy staraly ženy. Možná i proto, že když do vody ukruply trošku moče a žabka pak začala za několik hodin klást vajíčka, znamenalo to dobrou, nebo špatnou zprávu, to podle situace. V každém případě žabka dala svým chováním jasně na srozuměnou, že lidský potomek "je už na cestě“. Ovulaci žabce spouštěl ženský hormon gonadotropin, který těhotným ženám koluje v krvi a odtud jim přechází i do moče. Zhruba od šedesátých let jsou dostupnější mnohem diskrétnější testy a žabky z mnohých domácností dostaly volnost. Jenže některé si ze své domoviny přinesly také houbu Batrachochytrium dendrobatidis. Na tu domácí druhy obojživelníků nebyly zvyklé a malér byl na světě. Od konce osmdesátých let minulého století to jde s obojživelníky s kopce. Vyhynulo jich už asi 120 druhů. Celé tři čtvrtiny z toho má na svědomí to, čemu se říká „zabo-mločí mor“ a jehož původcem je ona zmíněná houba.

O akvária se nyní zase starají muži a dostupnost drápatky z ní udělala modelový organismus vývojové biologie. Na Tufts University se drápatkami a hlavně jejich zrakem, zabývají už hezkých pár let. Před čtyřmi lety jsme o výsledcích tamních pokusů na pulcích drápatky už referovali. Už tehdy šlo o transplantaci buněk vznikajícího oka a také se jim dařilo na novém místě založit vznik oční bulvy. Nicméně s její funkčností to tehdy bylo ještě hodně na štíru.
Nyní je to ale už jiná káva. Transplantované oko se podařilo mnohem lépe propojit s mozkem. Paradoxní na tom je, že k tomu organismus využívá zcela jinou „přenosovou soustavu“. Nikoli oční nerv, jak bývá normálně zvykem. To ale znamená, že informace z nového oka se v mozku dostávají do jiných míst, než normálně. A protože v řadě případů je extra oko funkční, je to důkaz ohromné plasticity mozku. I když je plasticita hodně zajímavý fenomén, dnes se budeme zabývat tím, jak a čím se vědcům podařilo nervové spoje vylepšit. Inervaci přesazeného oka dosáhli látkou, která působí na serotonergní signalizační dráhu. V publikaci autoři zmiňují agonistu 5-HT 1B / D. Laicky řečeno, jde o lék na migrénu známým jako Zolmitriptan. Ten selektivně působí na serotoninové receptory subtypů 1B a 1D.
Že jde o látku přenesenému oku prospěšnou, si Američané ověřili tak, že nejprve pulcům transplantovali na ocas základ oka. Ale jen polovině z nich vykoupali přenášený transplantát v Zolmitriptanu. Když pulcům cizí tkáň začala přirůstat, naroubovaný základ oka jim zase vyjmuli a díru zalátali jejich vlastními ocasními buňkami. Ani ne po týdnu se ukázalo, že Zolmitriptan v daném místě růst nervových spojů (neuritů) výrazně vylepšil.

A jak si vědci ověřili, že pulci svým ocasním okem také vidí?
K tomu si vyrobili vlastní testovací zařízení, v němž půlce cvičili jako v cirkusu. Komůrky jim rozdělili na část osvětlenou modře a část červeně. Jakmile si pulec zaplaval do červené zóny, dostal elektrický šok. Poměrně rychle prý začali chápat, která zóna je zakázaná. Je potřeba ještě dodat, že pulce v pokusu nejprve oslepili, než jim provedli transplantaci, která jim přivodila mít oko vzadu na ocasu, místo na hlavě. Pak už jen stačilo pozorovat, zda ocasatí kyklopové, jimž štěp ošetřili Zolmitriptanem, volí modrou oázu klidu častěji.

Počítání dopadlo příznivě. Ze skupiny pulců, kterým se nedostalo léku, jich bylo schopno novýma očima rozlišit barvu jen 11 procent. Z těch, co dostali Zolmitriptan, to bylo 29 procent. Vzhledem k tomu, že pulcům moc učení nejde, neboť naučit se rozlišovat barvy se zdařilo v kontrolním testu pulcům s oběma normálníma očima jen v 67 procentech, lze výsledek považovat za „úžasný“. Další testy ukázaly, že pulci novým okem vidí nejen barvu, ale že jsou jím schopni rozeznat i tvary a pohyb. Ten pulci novým naroubovaným okem byli schopni sledovat dokonce v 57 procentech případů. Samozřejmě, že také jen ti, co se "léčili na migrénu". Příznivá statistika opravňuje vědce tvrdit, že ocasní oko si svou funkci plní.
Nejde tu ale jen o zrak. Orgánů, které po transplantaci strádají neschopností se domluvit s mozkem, je daleko více. Ne vše je totiž řízeno v našich tělech hormonálně a řadu jemných nuancí mozek dolaďuje právě prostřednictvím nervů. Tyto křehké vazby chirurgové přeřežou a s jejich napojením na novém místě si už hlavu nelámou. Bylo by to zbytečné, protože technicky tak jemné předivo zatím spojovat neumíme. Proto je i sebemenší vylepšení samovolné obnovy sítě neuritů tak důležité. Skýtá naději přinést pokrok v celé řadě oblastí medicíny.
Odpůrci drastických metod a transplantací s embryonálními buňkami Blackistonovu týmu vytýkají, že k léčbě slepoty volil zbytečně složitou, zdlouhavou a útrpnou cestu. A že již byl popsán i lepší výsledek. Kdysi k tomu stačil plivanec na zem, kterým se oči potřely. Pak už jen zbývalo si to bahno smýt v rybníce Siloe.
Závěr
Doufejme, že až dozraje čas na prověřování metody v klinické praxi, budou výzkumníci při výběru místa obezřetnější. Nebylo by velkou výhrou koukat si celý život do zadku...
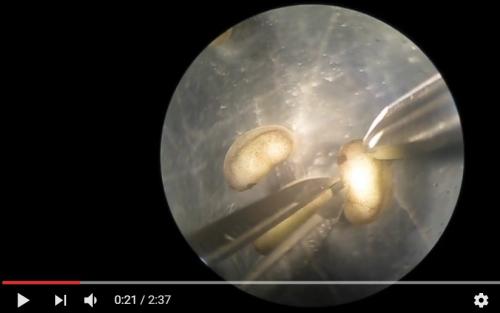
Jak půlcům Američané oči transplantují, je možné shlédnout na videu zde.
Literatura
Douglas J. Blackiston et al, Serotonergic stimulation induces nerve growth and promotes visual learning via posterior eye grafts in a vertebrate model of induced sensory plasticity, npj Regenerative Medicine (2017). DOI: 10.1038/s41536-017-0012-5
Jan, 9, 1-12