Novinka?
Nejspíš namítnete, že s magnetickými nanočásticemi, jako nosiči léků, se experimentuje už dlouho, že v praxi často selhaly a že o žádnou novinku nejde. Ale jde.
Jedním z prvních propagátorů léčby pomocí směrovaných nano-částic byl Andrew Harrison. Skot pracující na University of Edinburgh. Ten se inspiroval u rybniční bakterie, která si ve svém tělíčku hýčká krystalky magnetitu. Hrudky Fe3O4 si nejprve obalí a pak z nich poslepuje delší tyčkovité útvary. Ty pak zastávají funkci střelky kompasu - orientují se podle siločar magnetického pole Země. I když jsou siločáry k zemskému povrchu poněkud skloněny, k orientaci, kde je nahoře a kde dole, to bohatě stačí.
Tam vznikla myšlenka drahá a nebo zvláště toxická léčiva navazovat na magnetitové útvary a dopravovat je pomocí magnetického pole tam, kde jich je nejvíc potřeba. Zdálo se, že nádory a jejich metastázy budeme moci cíleným zásahem cytostatik snadno likvidovat a rakovina se stane minulostí. Magnetickým polem sice šlo přinutit magnetitové částečky aby nám neutíkaly kam nechceme, ale optimismus opadl, když se ukázalo, že se částečky se na sebe nabalují až vytvoří velké chuchvalce. Ty pochopitelně neměly šanci rostoucí nádory udržet na uzdě. S cytostatiky na nic nenavázanými se dosahovaly lepší výsledky a feromagnetismus v tomto ohledu propadl.
Proč HeLa buňky?
V publikaci o které je tento článek se stále omílají HeLa buňky, až člověk nabude dojmu, že mají nějaký význam. Pod zkratkou „HeLa“ se skrývá Henrieta Lacksová z Virginie, která onemocněla karcinomem děložního krčku a na agresivní rakovinu i přes léčbu ozařováním umřela. Jde o dávno zapomenutá záležitost ze 4. října 1951. Tehdy jí v americké Nemocnici Johna Hopkinse odebrali vzorek nádorové tkáně a následná kultivace ukázala že jde nejen o zvlášť zákeřného protivníka, ale také že se tyto zvrhlé buňky snadno kultivují. Proto se rychle šířily z laboratoře do laboratoře a dnes tvoří jakýsi buněčný standard. Henrietta Lacksová a její genom tak v jistém smyslu jako HeLa buňky žijí dál. V tomto případě ale orientace na agresivní rakovinné buňky neměla žádný hlubší význam. Stejně, jako v HeLa buňkách se testované nano-částice budou chovat i v jakékoliv jiné zdravé tělní buňce. Matoucí skloňování HeLa rakoviny si je v tomto případě potřeba přeložit tak, že jediným důvodem použití těch buněk byla jejich snadná dostupnost a láce.
Proč zlato a ruthenium?

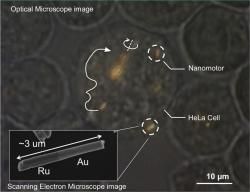
Protože není jen feromagnetismus. Nanomotory, o kterých tu je řeč, jsou vlastně jen obyčejné tyčky ze zlata a ruthenia. Důvod je že nereznou, ale hlavně se chovají jako Jackyll a Hyde. Zatímco zlato je diamagnetikem, ruthenium je paramagnetické.
Diamagnetismus
U látek zvaných diamagnetika je výsledný magnetický moment jejich atomů nulový. Pokud je vystavíme magnetickému poli, v atomech se poněkud změní uspořádání elektronových obalů a vytvoří se magnetické dipóly. Jejich magnetické pole pak působí proti vnějšímu magnetickému poli.
Paramagnetismus
Atomy látky s touto vlastností mají v orbitalu nepárové elektrony. Vykazují trvalý magnetický moment, dokonce i za nepřítomnosti vnějšího pole. Zatímco při nepřítomnosti vnějšího pole jsou náhodně orientované, takže celkový magnetický moment je nulový, v magnetickém poli se dipóly natočí, a vytváří magnetický moment, který je orientován ve směru působení vnějšího pole.
To, co mají dia- a paramagnetismus společné je, že se objevuje až v přítomnosti vnějšího magnetického pole a to je zásadní rozdíl feromateriálů. Dia- a paramagnetické látky nedokážou udržet magnetismus bez přítomnosti vnějšího pole to znamená, že po „vypnutí“ nemají tendenci se shlukovat a tvořit dále již nevyužitelné robustní konglomeráty, jako je tomu v případě feromateriálů.
První generaci nanomotorů vědci připravili zhruba před deseti lety. U jejich zrodu stál chemik Ayusman Sen a fyzik Vincentem Crespi.
Princip jeden mikron dlouhého tyčinkového nanomotoru využívajícího zlato v kombinaci s platinou lapidárně znázorňuje video z dílny Scientific American, ke shlédnutí na zde (princip je až od času 2:26). Přední část tyčinky s platinovým povrchem odnímá z okolo proudícího prostředí v němž se vyskytují molekuly dihydrogen peroxidu elektrony, které se následně posunují po povrchu tyčinky ve směru obtékající kapaliny. Stejným směrem pak putují i protony. Jejich kladný náboj je pro molekuly vody atraktivní a strhává je s sebou. Zlatý konec tyčinky pak katalyzuje tvorbu molekul vody, palivem jsou tedy molekuly dihydrogen peroxidu. Doprovodné elektromagnetické síly chemické reakce rozpohybují nanotyčinku proti směru proudící kapaliny. Funguje to, ale má to jeden velký hendikep. K tomu aby vše běželo, potřebují toxickém palivo (peroxid vodíku). To se živým buňkám moc nelíbí a odmítají spolupracovat. Těmto motorům, kterým se říká katalytické, s novým poznatkem možného pohonu zvukovými vlnami, nejspíš odzvonilo.

Na myšlenku změnit motoráře přivedl Američany Francouz, fyzik Mauricio Hoyos svými výsledky pokusů s ultrazvukovými vlnami a jejich účinkem na nanostruktury. Všichni víme, že ultrazvuk nanočástice rozkmitá, což podporuje jejich udržení v dispersním stavu a také jejich prostup přes buněčné membrány dovnitř buněk. Nově si k tomu můžeme přidat, že na obou koncích podlouhlé nanočástice dochází k rozptylu zvukových vln a že pomocí dostatečně silných ultrazvukovými pulsů o frekvenci okolo 4 MHz lze titěrné tyčinky roztočit a zajistit jim dopředný pohyb. Pomocí akustických zrcadel můžeme ultrazvuk směrovat a měnit osu toku vln. Pokud jsou tyčky z jedné poloviny diamagnetické a druhé paramagnetické, můžeme takové útvary ultrazvukem pošťuchovat vpřed a pouštěním na ně elektromagnetického polem je trochu kormidlovat.

Ultrazvuk a vnější magnetické pole je lákavá kombinace a o nadějných výsledcích je už slyšet i z jiných laboratoří. Nanočástečky s paramagnetickými vlastnostmi testují například na University of Central Florida. Tam pro změnu využívají Cer. S jeho pomocí vychytávají v buňkách kyslíkové radikály a brání tak jejich nežádoucím účinkům. To se může hodit například po ozařování při léčbě rakoviny. Ale také při našich plánovaných výletech do kosmu.
Pravdou je, že rotující nanostruktury v buňce jsou spíš mixérem utrženým z řetězu a že k proklamované nitrobuněčné chirurgii to má zatím hodně daleko. Na druhé straně ale i jen pouhá promenáda těchto vrtičů v cytoplasmě a jejich neomalené vrážení do všeho co se jim namane, mohou být užitečné. Uvnitř buněk je totiž celá řada struktur, které mají opticky stejné vlastnosti, jako zbytek cytoplazmy. Nelze je vidět. Tím, jak se tyto neohrabané "ponorky" zamotávají do nitrobuněčných sítí, dávají nám představu o pevnosti tenat, vzájemném propojení organel,... Pro cytology to bude vděčná hračka.
Chování tyčinek mezi buňkami v dosahu akustického pole při pěti set násobném zvětšení ukazuje video. Při jejich aktivním šmejdění se některým podaří vniknout i do HeLa buněk, jiné se pevně „zaseknou“ na jejich povrchu:
Kredit: Mallouk Lab, Penn State University
Nejde vždy jen o to, dostat nanoroboty dovnitř buněk. Pro některé účely stačí aby tyčinky interagovaly (do budoucna třeba pomocí navázaných protilátek) s povrchovou strukturou buněk. I takové spojení se buňkám stane osudným a musí ve směru akustického paprsku tancovat podle toho, jak pískáme:
Kredit: Mallouk Lab, Penn State University
S trochou nadsázky lze říci, že ultrazvukové impulsy dávají nanomotorům energii a příkaz „mrsknout s sebou“ a směr pohybu je v režii elektromagnetických sil. Ovládnutí buněčných mas ve stylu „kupředu,zpátky ni krok“ je prý pro naší budoucnost velkou devízou. Výhledově se totiž počítá s autonomním pohybem nanorobotů za účelem selektivního ničení rakovinových buněk.
Poslední video ukazuje v tisícinásobném zvětšení, jak lze „tyčky“ směrovaným akustickým polem dirigovat i uvnitř jediné rakovinové HeLa buňky:
Pokud to naše zdravotní makro-pilíře ustojí, budou prý tyčkovité nano-pilíře brouzdat také uvnitř našich tělesných schránek. Budou spolu komunikovat, stanovovat diagnózu a léčit nás od všeho zlého.
Literatura: Angewandte Chemie International Edition , 10.2.2014
Pennsylvania State University

