Antibiotiká fungujú tak, že narušujú metabolizmus mikroorganizmov. Nejde o fyzickú likvidáciu, skôr o záludnú otravu metabolicky aktívnych, množiacich sa jedincov. V populácii mikróbov sa vyskytuje aj množstvo metabolicky málo aktívnych, nedeliacich sa "driemajúcich" buniek - persisterov, ktoré dokážu tolerovať účinok bežných antibiotík. (poznámka - jedná sa tu o toleranciu antibiotík, nie o rezistenciu - tolerancia sa na rozdiel od rezistencie nededí). Perzistujúce mikróby sa ukrývajú v povlaku - biofilme napríklad na povrchu umelých materiálov - katétrov, protéz, unikajú účinku antibiotík a sú príčinou opätovného vzplanutia infekcii.
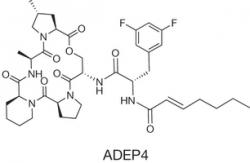
Na perzisterov zo skupiny grampozitívnych baktérii však účinkuje nová trieda antibiotík - acyldepsipeptidy (ADEP). Tieto ireverzibilne aktivujú proteín ClpP - podjednotku enzýmu zo skupiny proteáz, ktorý sa podieľa na regulovanej degradácii špecifických proteínov. Fígeľ spočíva v tom, že v prítomnosti ADEP proteolýza sprostredkovaná ClpP nie je závislá na dodávke energie v podobe adenozíntrifosfátu (tým ani na aktivite metabolizmu mikrobiálnej bunky). Výskumníci si to všimli a vyskúšali účinok acyldepsipeptidu ADEP 4 na stafylokoky.
V prvých experimentoch vystavili účinku acyldepsipeptidového antibiotika ADEP 4 driemajúce baktérie Staphylococcus aureus. To sú veľmi nebezpečné mikroorganizmy, ktoré si vypestovali rezistenciu proti väčšine známych antibiotík. Prežívajú v nemocničnom prostredí a spôsobujú okrem iného aj ťažko liečiteľné infekcie operovaných pacientov. V experimente došlo k degradácii viacerých baktériových proteínov v mnohých metabolických dráhach. Počet bakteriálnych buniek sa znížil o niekoľko rádov, ale prežili bunky s deficitom ClpP.
Kredit: Nature
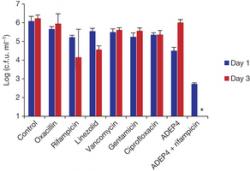
Rast selektovanej populácie s deficitom ClpP je zlou správou, ale je tu aj lepšia: kombinácia ADEP 4 s bežnými antibiotikami ciprofloxacinom, linezolidom alebo rifampicinom bola synergisticky baktericídna nielen in vitro ("v skúmavke"), ale aj u pokusných myší s chronickou infekciou Stafylococcus aureus v biofilme, ktorá predtým nereagovala na liečbu rifampicinom a vankomycinom (vankomycin pritom patrí medzi veľmi účinné, ale toxické antibiotiká, používané ako jedna z posledných možností). Kombinovaná liečba ADEP 4 a rifampicinom však dramaticky znížila počet mikróbov až pod hranicu detekovateľnosti.
Rýchly nástup ClpP deficientných mutantov po vystavení acyldepsipeptidu hneď na počiatku poukazuje na potenciálne obmedzenie tejto novej skupiny antibiotík. Ďalším obmedzením je, že príliš veľká molekula ADEP nepreniká cez membrány gramnegatívnych baktérii, medzi ktoré patrí napríklad problémová Pseudomonas aeruginosa. Ale tento výskum ukázal, že antibiotiká zacielené na metabolické dráhy driemajúcich mikroorganizmov sa môžu stať užitočným nástrojom na liečbu chronických infekcii, z ktorých veľkú časť spôsobujú práve driemajúce baktérie v biofilme.
Zdroj: B.P. Conlon et al., “Activated ClpP kills persisters and eradicates a chronic biofilm infection,” Nature, doi:10.1038/nature12790, 2013 a komentáre ZDE.