Nejde o vtip, ani o předvolební reklamu ODS. Jde o výsledky seriózních pokusů, které byly publikovány v jednom z nejprestižnějších časopisů věnovaných biologickému výzkumu - sborníku americké Národní akademie věd. Zdá se, že se částečně podařilo vyřešit to, co z poranění míchy činí nevratné poškození – jde o komplikace související s „druhotným“ poškozováním.
ATP dokáže škodit

Adenosin trifosfát, známý pod zkratkou ATP, je pro buňky životodárným zdrojem energie. Před několika lety se ale zjistilo, že krátce po úrazu míchy koncentrace ATP v místě poranění výrazně roste. To však pro pacienta neznamená nic dobrého. ATP totiž v místě poškození zabíjí a to i ty buňky, které úraz nikterak nepoškodil a teoreticky by se mohly znovu propojit a obnovit dřívější komunikaci. Poškozením míchy navozený příliv ATP ale tyto zdravé buňky ničí. Stav zraněného se tak stává ještě bezradnějším, než by se mohlo na první pohled zdát. Toto „druhotné“ poškození se vědci již nějakou dobu snaží eliminovat. Jediné pokusy, které v tomto směru dopadly dobře, souvisí s injekcemi oxidované formy ATP. Injekce této látky umí nežádoucí efekt škodlivého „normálního“ ATP částečně utlumit. Zvířatům, kterým aplikovali oxidovaný ATP se pak poraněná mícha lépe hojila a některá z ošetřených zvířat byla schopna se znovu naučit používat ochrnuté končetiny a začala chodit.
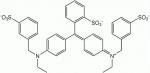
Oxidovaný ATP a briliantová modř
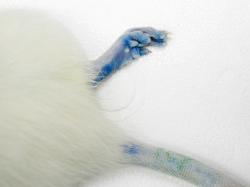
Někdy v roce 2004 tým Maiken Nedergaardové (první autorky publikace) přišel na to, že mícha je bohatá na molekulu nazývanou P2X7. Jde o strukturu, která je známa spíše pod označením „receptor smrti“. Říká se jí tak pro její schopnost dovolit ATP navázat se na motorické neurony a vyslat jim tím signál, po kterém se dokážou zničit. Nedergaardová začala tušit, že briliantová modř, která má podobný účinek na neurony jako oxidovaný ATP, by se mohla stát hledanou substancí, která by zlou roli „smrtícího receptoru“ mohla mařit a chránit poraněním obnažené buňky. Díky tomu, že se prakticky jedná o potravinářské barvivo, vědci dostali od amerického Úřadu pro potraviny a léčiva povolení k provedení testů. Ukázalo se, že to funguje. Potkani, kterým dali modrou injekci BBG bezprostředně poté, co jim přestřihli míchu, dokázali po rekonvalescenci zase chodit. Jde spíše o kulhání, ale je to pohyb „po vlastních“, což je ohromný úspěch. Potkanům, kterým modré injekce nepodávali, se k vlastnímu pohybu již nikdy nedopracovali.
Proč ne oxidovaný ATP, ale modř ano?

U lidí by použití oxidované formy ATP mělo fungovat, ale v praxi by se neuplatnilo. Důvody jsou hned dva. Předně tento preparát nejde pro jeho nežádoucí účinky aplikovat intravenózně. To znamená, že zbývá přímá aplikace do míchy. A ruku na srdce, kdo ze zdravotníků by si dobrovolně bral na triko dloubat se pacientovi někde v terénu injekční jehlou v jeho porušené míše s vědomím, že tím může nadělat více škody než užitku?

To, že by mělo jít oxidovaný ATP nahradit pouhou injekcí barvičky do žíly, zní téměř jako rajská hudba. Stačí si uvědomit, že i to nejmenší zlepšení je úspěch. Ať už jde o znovunabytí kontroly nad močovým měchýřem, nebo malý krůček na vlastních nohách. Pro ty, jež jsou trvale upoutáni na lůžko bez možnosti se pohnout, se jedná o cíl, jehož význam si jen těžko dokážeme představit. Úspěch léčby za pomoci barvičky ale má jeden háček. Vše závisí na tom, zda se podaří barvivo podat poraněnému bezprostředně poté, co se mu úraz přihodil. Tedy ještě předtím, než buňky a tkáně v místě přerušení stihnou vlivem nárůstu ATP odumřít, což představuje zřejmě dobu okolo patnácti minut.
Od receptoru pro ATP k aktivaci buněk
Receptor P2X náleží k purinovým receptorům pro adenosin trifosfát (ATP). Tento receptor řídí hradlo iontového kanálu. Kanálky v membráně jsou onou bránou, která rozhoduje, zda jimi projdou ionty a zda lýza, na které se ATP účastní, nastane, nebo ne. Jde o řízení procesu při kterém se hraje o to, zda membránové póry dostanou příkaz k propustnosti pro velké molekuly. Takové rozhodnutí je pro makrofágy dokonce příkazem k sebevraždě. Vždy ale nejde o extrémní případ apoptózy (programové smrti buňky). Aktivace receptoru v jádře pomocí přítomnosti ATP v cytoplazmě je také mechanismem, kterým si buňky regulují genovou expresi, tedy něco, co rozhoduje o tom, “na jak sešlápnutý plyn” jejich geny pojedou.
To, že molekula briliantové modři dokáže membránový receptor ošálit znamená, že také umí utlumit aktivaci neuronů. Tedy umí zamezit tomu, co po zranění míšním buňkám škodí a brání opětovnému propojení drah.
Čím modrá léčí
Brilliant Blue G je syntetické barvivo, které lze vyrobit například z uhelného dehtu. V kombinaci s tartrazinem se používá k docílení různých odstínů zelené barvy. Často se používá ve formě sodné, vápenaté, případně hořčíkové soli. Chemický vzorec: C37H34N2Na2O9S3. Při běžné konzumaci modrých potravin nezmodráme, protože 95% požitého barviva odchází s výkaly, nevstřebává se do krevního řečiště. Preventivní perorální podávání léku tedy nepřipadá v úvahu.
Ošetření pomocí barvičky (BBG) má na míchu hned několik efektů. Tím, že buňkám obludíme jejich receptory, snížíme aktivace astrocytů a mikroglií. Dochází ale též k omezení infiltrace neutrofilů do porušeného místa. To znamená, že barvička nejenže chrání míšní neurony před tím, aby je při obnažení vzniklém při poranění zničila jejich excitace navozená adenosin trifosfátem (ATP), ale vyvaruje poraněné místo také tlačenici neutrofilů – jinak řečeno, tlumí zánět. V obou případech se jedná o blahodárný vliv - o zamezení sekundárních škod a o zvýšení šance, že mícha sroste a bude zase přenášet vzruchy.
Briliantová modř (BBG barvička) je látka, která je považována za bezpečnou, protože její dlouhodobé používání v cukrovinkách a limonádách zatím žádné riziko nesignalizuje. Lékaři se staví za zahájení okamžitého používání této látky v medicínské praxi. Vše nasvědčuje tomu, že modrá krev přestane být výsadou šlechticů. Na jednotkách intenzivní péče zřejmě brzo zmodrají všichni, u nichž vznikne jen podezření, že by mohli mít něco s páteří.