Rozdílnost tvarů živých organismů se dotýká celé řady aspektů biologie, a vlastně nejen jí. Řecký základ slova morfologie napovídá, že právě uvědomění si a pozorování těchto odlišností stálo u vzniku biologie jako disciplíny. Později tvořilo podstatu systematiky. Paralelně ale pestrost tvarů organismů vstupovala do kultury: první malby na stěnách jeskyní zachycují opět vnější tvary organismů. Uvědomění si tvarové rozmanitosti organismů je pochopitelně přítomno i ve Starém zákonu.

Anatomická vyobrazení vnitřních struktur přicházejí později. A obrázky nejrůznějších interakcí molekul v živých systémech jsou výsadou až dnešní doby. Ale právě sestoupení na úroveň molekul nás opět vrací ke tvarům živých organismů - začínají se poodhalovat mechanismy, které stojí za vznikem těch nejrůznějších tvarů, jak ve smyslu ontogenetickém, tak ve významu fylogenetickém.
Na cestu vedoucí přímo k mechanismům určujícím stavební plán organismů přivedl vědu jev nazývaný homeoze. Je to vlastně změna nějaké morfologické struktury v jinou. Jako příklad lze uvést transformaci krabího oka v tykadlo, nahrazení tykadla hmyzu končetinou, přeměnu hmyzí nohy v křídlo, některé případy nadpočetného (šestého) ramena mořských hvězdic a nakonec přeměnu sedmého krčního obratle člověka v hrudní, což se projeví přítomností žeber. Také se někdy u lidí objevují další páry prsních bradavek.
Cytogenetické metody umožnily lokalizovat na chromozomech původce homeoze - homeotické mutace, způsobené například chromozomovým zlomem v místě určitého genu.
Jakmile pokrok biologických technik přinesl možnost klonovat geny v plasmidových vektorech , otevřela se možnost izolovat i tyto geny. Problém spočíval v izolaci prvního homeotického genu, protože o něm nebylo vlastně nic známo. Byla tedy využita metoda takzvaného "chromosome walking\" - tedy \"putování po chromozomu\". Pomocí této metode pátrá v genomových knihovnách. Jako první byl použit plazmid s genem, o kterém bylo známo, že leží na chromozomu blízko zlomu, který způsobuje homeotickou mutaci. Sousední sekvence každého genu se s ním vždy částečně překrývají, takže s ním hybridizují. Tak byly získány další dva vektory s jinými geny. Ty potom byly použity pro další hybridzaci. Tento postup se stále opakuje a tak se "kráèí" po chromozomu dvěma opačnými směry (jen jeden je ovšem ten správný), až se nakonec dojde ke genu původně zasaženému chromozomovým zlomem. Prvním takto "uloveným" a klonováním zmnoženým homeotickým genem byl Ultrabithorax.
Když byla namnožená DNA sekvenována, byla objevena 180 párů bazí dlouhá oblast s konzervovanou sekvencí nukleotidů. Míra homologie této oblasti, pojmenované homeobox, dosahovala mezi různými homeotickými geny 75 - 77 %. Translací genů s homeoboxem vzniká protein, nesoucí úsek, který odpovídá homeoboxu. Tento úsek, pojmenovaný homeodoména, se dokáže vázat do regulačních oblastí dalších genů a tím zapínat, vypínat, případně modulovat jejich transkripci.
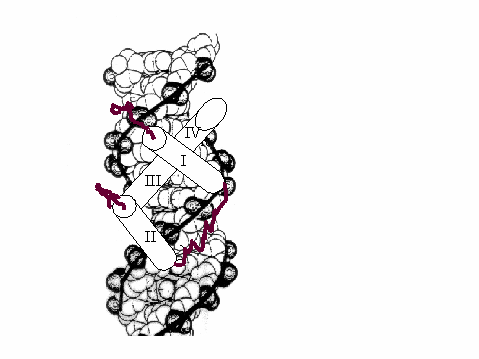

Homedoména je tvořena čtyřmi a - helixy. V případě homeodomény proteinu Antennapedia je první a -helix ohraničen aminokyselinami 10 a 21, druhý aminokyselinami 28 a 38, třetí se nachází mezi reziduy 42 - 52 a čtvrtý 53 - 59. Třetí a čtvrtý a -helix leží v jedné přímce a společně zapadají do velkého žlábku dvoušroubovice DNA. Ke kontaktům s ní dochází především prostřednictvím zásaditých aminokyselin, které z a -helixů vyčnívají směrem k DNA. Na odvrácené straně a-helixu naopak vyčnívají kyselé aminokyselinové zbytky. Mezi N-koncovým neuspořádaným úsekem homeodomény a malým žlábkem dvoušroubovice DNA pak dochází k dalším interakcím. Dokonce aminokyselinová sekvence této koncové části přispívá ke specificitě vazby homeodomény konkrétního genu a někdy ji zcela určuje. Součástí tohoto N-koncového úseku je i silně zakonzervovaný motiv čtyř aminokyselin - YPWM motiv. Obr.
U jednobuněčných eukaryontních organismů byla homeodoména nalezena jako součást proteinového represoru Mata 2 kvasinky Sacharomyces cerevisiae, který blokuje transkripci genu opačného párovacího typu.
První poznatky o funkci homeoboxových genů během ontogeneze přinesl výzkum prováděný na octomilce (Drosophila). Geny, které řídí postupné rozčlenění vyvíjejícího se zárodku octomilky v předozadní ose pracují v časové posloupnosti, kdy jako první se uplatní takzvané "maternal effect" geny (bicoid, caudal), které vytvoří dva protichůdné proteinové gardienty - jeden anterioposteriorní (bicoid), druhý posterioanteriorní (caudal).
mRNA pro oba proteiny je produkována okolními buňkami matky ještě během vývoje vajíčka. Jejímu vstupu do vajíčka a lokalizaci v něm napomáhají produkty genů exuperantia (exu), swallow (swa) a staufen (stau). Teprve oplození vajíčka spermií spouští translaci mRNA genu bicoid na protein s homeodoménou, který, tím jak difunduje z předního konce, vytváří gradient. Protein bicoid se přitom svou homeodoménou váže na mRNA caudal a blokuje ji. Caudal mRNA, jejíž koncentrace ve vajíčku je zprvu všude stejná, je díky této represi translatována na různých místech v různé míře, takže vznikající protein caudal vytváří gradient protichůdný ke gradientu bicoid.
Maternal effect geny ovšem utvářejí i dorzoventrální gradient: Protein - transkripční faktor dorsal, který je produktem maternal effect genu dorsal se v buňkách na ventrální straně embrya akumuluje v jádrech, zatímco směrem k dorzální straně se zvyšuje jeho podíl v cytoplazmě a klesá koncentrace v jádru. Jeho vstup do jádra je regulován produktem dalšího maternal effect genu - proteinem cactus. Dorzoventrální gradient je tak tvořen koncentrací proteinu dorsal v jáderch buněk, rostoucí směrem k ventrální straně embrya. Tam také dorsal aktivuje geny twist a snail, které determinují vývoj mezodermu. Naopak dorsal blokuje expresi genů decapentaplegic (dpp), tolloid a zerknüllt (zen). Ta svobodně probíhá na opačné straně a zodpovídá za její dorzální charakter.
Cestu ke studiu \\"maternal effect\" genů otevřela svými pokusy s odstraňováním cytoplazmy z pólů vajíčka nebo transplantacemi mezi nimi německá badatelka Christiane Nüsslein-Volhard.
Informace obsažená v morfogenetických gradientech mezi anteriorním a posteriorním pólem embrya je v dalším kroku převedena do již ostřeji vymezených, stále však velmi širokých pásů. To zprostředkovávají geny ze skupiny gap.
Ukázalo se, že geny ze skupiny gap (viz tabulka) nemají homeobox, ale jimi kódovaný protein využívá k vazbě na DNA zinkové prsty.
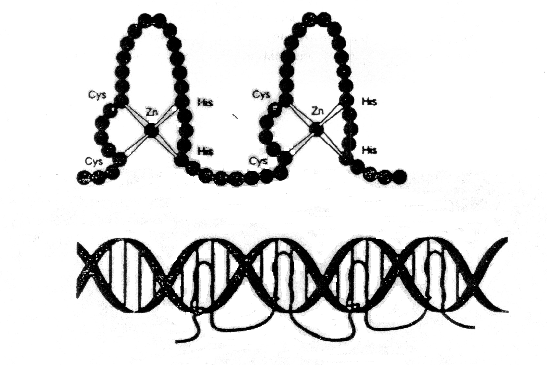

Významným gap genem je hunchback. Jeho exprese je stimulována proteinem bicoid, takže protein hunchback je jakýmsi \\"prodloužením\\\" gradientu bicoid posteriorním směrem. V zadní části embrya je však blokován proteinovým produktem maternal effect genu nanos. Hunchback blokuje expresi dalšího gap genu Krüppel .
Důležitou dvojicí gap genů jsou Krüppel (Kr) a knirps (kni). Tvar jejich koncentračního gradientu charakterizuje Gaussova křivka. Gradient proteinu Krüppel má maximum více anteriorně, zatímco protein knirps dosahuje maxima více směrem k posteriornímu pólu embrya. Oba gradienty se částečně překrývají. Krüppel inhibuje expresi pair rule genu hairy, zatímco knirps ji aktivuje. Tím je vytvořen poměrně úzký pás proteinu hairy na rozhraní druhé a třetí třetiny embrya.
Mezi pair rule geny patří u octomilky (Drosophila) kromě již zmíněného hairy geny even-skipped a fushi tarazu. Hairy se po délce vyvíjejícího se embrya objevuje opakovaně, ne jen v pásu regulovaném dvěma zmíněnými gap geny. Další pásy exprese genu hairy jsou však odpovědí na jiné kombinace gap genů.
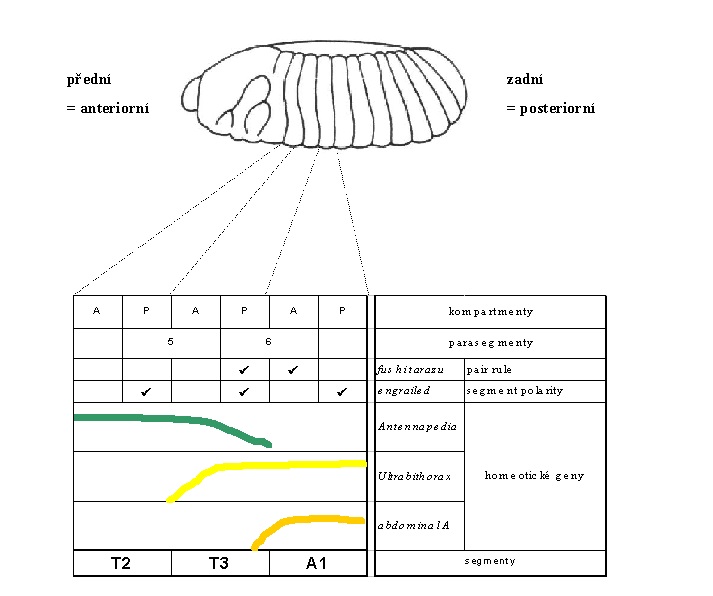
Geny ze skupiny segment polarity jsou exprimovány poněkud později během vývoje embrya - ve stadiu pozdního blastodermu nebo časné gastruly. S tím souvisí, že vytvářejí kompartmenty na té nejjemnější úrovni vznikajícího "rastru\\". Gen engrailed takto rozděluje segmenty na přední a zadní část, kdy engrailed je exprimován vždy v zadní - posteriorní části.
|
skupina
|
příklady genů |
homeodoména nebo zinkové prsty
|
akce - funkce
|
|
maternal effect
|
bicoid
caudal nanos dorsal |
homeodoména
|
morfogenetické
(anterioposteriorní, posterioanteriorní, dorzoventrální ) gradienty |
|
gap
|
hunchback Krüppel (Kr) knirps (kni) |
zinkové prsty
|
široké pásy (domény)
|
|
pair rule
|
hairy even-skipped fushi tarazu |
homeodoména
|
segmenty (a/resp. parasegmenty) |
|
segment polarity
|
engrailed
|
homeodoména
|
"polosegmenty" - kompartmenty
|
Každý jednotlivý kompartment je potom specifikován unikátní kombinací homeoboxových genů (a genů kódujících proteiny se zinkovými prsty):
Rozrůznění vyvíjejícícho se embrya do jednotlivých segmentů a ještě jemněji do kompartmentů má zásadní účel, kterým je určit v jakém vývojovém směru se budou buňky v jednotlivých kompartmentech diferencovat. Toho je dosaženo regulací dalších homeoboxových genů. Jako příklad je možné uvést represi genu distal - less (Dll) homeodoménou proteinu Ultrabithorax. Distal - less přitom ovlivňuje vývoj končetin. Jeho represí je tedy zabráněno v utváření končetin v příslušném kompartmentu.
V případě octomilky (Drosophila), která patří mezi hmyz s proměnou dokonalou (Holometabola) je vztah mezi jednotlivými kompartmenty vyvíjejícího se embrya a konečným utvářením těla dospělé mouchy zprostředkován pomocí imaginálních disků (terčíků), které se zakládají již během embryogeneze a tudíž jsou ovlivněny unikátní kombinací různých transkripčních faktorů s homeodoménou v jednotlivých kompartmentech. Ve stadiu kukly pak zaniká většina původních tkání larvy a tělo dospělce se vyvíjí dělením a růstem imaginálních disků.
Většina homeoboxových genů je u octomilky (Drosophila) umístěna do dvou komplexů (klastrů), společně označovaných HOM, na 3. chromozomu. V komplexu Antennapedia jdou za sebou geny labial, proboscipedia, zerknüllt, bicoid, Deformed, Sex combs reduced, fushi tarazu a Antennapedia. Druhý komplex, pojmenovaný Bithorax nese geny Ultrabithorax, abdominal-A a Abdominal-B.

Hranice mezi komplexy Antennapedia a Bithorax , tvořená "vloženým" úsekem DNA, nejde u různých druhů hmyzu vždy mezi geny Antennapedia a Ultrabithorax. Dokonce ani oddělení těchto dvou komplexů od sebe není pravidlem, takže geny obou mohou tvořit jeden spojený klastr.
U myši tvoří obdobu komplexu HOM klastr Hox, který se nachází na čtyřech různých chromozomech, takže existuje Hox A, Hox B, Hox C a Hox D. Pořadí genů v klastru Hox A je A1 až A7, A9 až A11 a A13, v klastru Hox B je B1 až B9 a B13, v Hox C je C4 až C6 a C8 až C13 a v klastru Hox D je D1, D3, D4 a D8 až D13.
Srovnání pořadí genů v klastru Antennapedia s jejich expresí v rámci anterioposteriorní osy ukázalo zajímavé korelace: labial je u vyvíjejícího se embrya octomilky (Drosophila) exprimován nejblíže přednímu pólu, následuje oblast, ve které je exprimován proboscipedia, dále Deformed, Sex combs reduced a nakonec Antennapedia. Exprese tohoto posledního genu z komplexu Antennapedia končí v posledním hrudním segmentu T3. V prostředním hrudním segmentu (T2) už ovšem dochází k expresi genu Ultrabithorax z komplexu Bithorax. Poslední hrudní segment je tak definován současnou expresí genů Antennapedia a Ultrabithorax. V prvním zadečkovém článku (A1) začíná exprese druhého genu komplexu Bithorax - abdominal - A a v segmentu A4 začíná exprese Abdominal - B.
Pořadí jednotlivých genů komplexu HOM tedy odpovídá tomu, jak jsou postupně exprimovány od předního k zadnímu konci embrya. Tento jev byl nazván pravidlo kolinearity. Později, ověřením na obratlovčím Hox klastru, byla potvrzena univerzální platnost tohoto pravidla. Toto lineární pořadí je ovšem narušeno geny, které jsou exprimovány periodicky na delším úseku předozadní osy (např. fushi tarazu).
Výzkum v této oblasti šel tedy po jakési spirále, kdy homeotické mutace nejprve vedly ke klonování genů s homeoboxem a charakterizaci jimi kódovaných proteinů s homeodoménou. Byla objasněna funkce homeodomény, která spočívá ve vazbě na DNA (RNA). Paralelní výzkum (také na octomilce Drosophila) ovšem ukázal, že většina homeoboxových genů hraje zásadní roli v postupném rozrůzňování vyvíjejícího se embrya do v čase se zvětšujícího počtu segmentů v anterioposteriorní ose, přičemž jen relativně malý počet ze všech zúčastněných genů může způsobit skutečné homeotické transformace. Jsou to ty homeoboxové geny, které je možno označit za skutečné homeotické geny. Sled událostí při vývoji embrya je pro snadnější pochopení možno obrazně rozdělit do dvou etap. V první dojde k vytvoření jemné sekvence kompartmentů, jak bylo popsáno výše. Ve druhé fázi pak "pravé" homeotické geny z HOM nebo Hox klastru na tomto "polotovaru\" dotvoří stavební plán budoucího dospělého živočicha.
U prakticky stavebně nejjednoduššího kmene mnohobuněčných živočichů - hub (Porifera) byly nalezeny jen jednotlivé homeoboxové geny. U žahavců (Cnidaria) se již předpokládá existence určité formy klastru. Mechanismus vzniku klastru z individuálního homeoboxového genu by mohl být založen na sérii duplikací, ke kterým dochází během crossing-overu: Výchozím předpokladem je sousedství obou do crossing-overu vstupujících kopií homeoboxového genu s transpozonem. Při crossing-overu potom dojde k výměně mezi vlákny DNA právě v oblastech transpozonů, které jsou vzájemně homologní. Tím vznikne jedno vlákno bez genu, druhé však se dvěma. Další duplikace už mohou probíhat mezi vlastními homeoboxovými geny, bez účasti transpozonu, přičemž geny uvnitř klastru jsou opakovanými crossing-overy unifikovány, zatímco s klesajícím počtem crossing-overů směrem k okrajům komplexu charakter homeoboxových genů více odráží nerušeně probíhající historii mutací a tím diverzifikace sekvence.
Ne všechny homeoboxové geny se nacházejí v klastru. Ty které jsou jednotlivě mimo něj mohou mít svůj původ zcela nezávislý na vývoji klastru, nebo naopak mohly být původně jeho součástí a během evoluce se přemístit mimo něj. O tom, že byly dříve součátí klastru pak svědčí jejich stejná "exon/intronová architektura" a také přítomnost motivu YPWMK, který je markerem drtivé většiny homeoboxových genů z klastru. Příkladem takových satelitních homeoboxových genů odvozených od klastru jsou empty spiracles (myšími homology jsou Emx1 a 2), caudal a orthodenticle (myšími homology jsou Otx1 a 2). Geny empty spiracles a orthodenticle jsou exprimovány v přední části vyvíjejícího se embrya, ještě před prvními geny z klastru. Gen caudal byl již zmiňován v předchozím článku.
Když bylo srovnáno rozložení konzervovaných aminokyselin z oblasti homeodomény a jejího okolí mezi sekvencemi homeoboxových genů ze zadního konce anterioposteriorní osy (ekvivalentních komplexu Bithorax octomilky Drosophila melanogaster) ukázalo se, že existují dva typy klastrů - jeden nese homeoboxové geny typu Ultrabithorax a abdominal - A, druhý typ klastru nese geny Lox5, Lox2, Lox4, Post1 a Post2. Ubx, abd - A typ klastrů byl nalezen u živočichů z vývojové větve prvoústých Ecdysozoa, která zahrnuje recentní kmeny Arthropoda (členovci), Onychophora (drápkovci), Tardigrada (želvušky), Priapulidea (hlavatci), Nematoda (hlístice) a další.
Klastr s homeoboxovými geny typu Lox5, Lox2, Lox4, Post1 a Post2 se naopak vyskytuje u živočichů z druhé vývojové větve prvoústých Lophotrochozoa, která je zastoupena recentními kmeny Mollusca (měkkýši), Nemertini (pásnice), Annelida (kroužkovci), Sipuncula (sumýšovci), Entoprocta (mechovnatci), Brachiopoda (ramenonožci) a dalšími.
Homologie mezi geny v přední části anterioposteriorní osy jsou obecnější a krom obou již zmíněných vývojových linií prvoústých zahrnují i Deuteorostomia (druhoústé) se kmeny Echinodermata (ostnokožci), Chordata (strunatci) a dalšími. Homologní dvojice tak tvoří geny labial/Hox1, proboscipedia/Hox2, Hox3 (nebo zerknüllt/Hox3), Deformed/Hox4, Sex combs reduced /Hox5 a Antennapedia/Hox6. Naopak sled konzervovaných aminokyselin genů Hox9 až Hox13 je unikátní pro Deuterostomia.
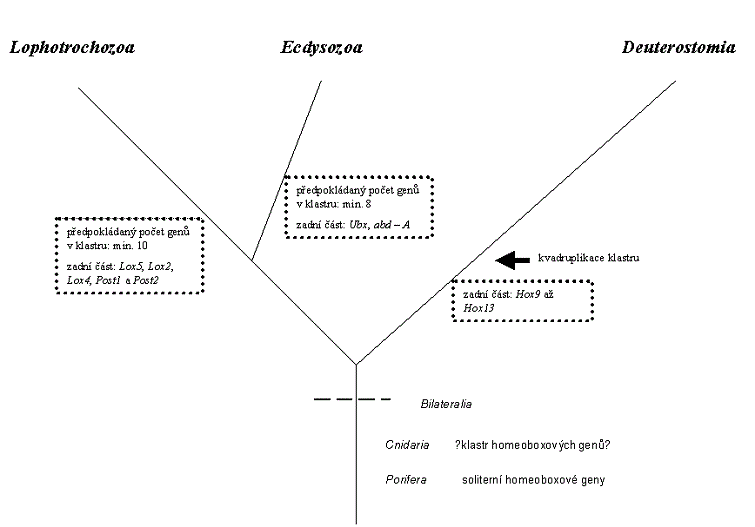
Dosavadní výsledky analýzy klastrů homeoboxových genů u různých druhů napovídají, že k vytvoření prvotního klastru procesem opakovaných duplikací došlo ještě před rozdělením vývojových linií mezi Deuteorostomia, Ecdysozoa a Lophotrochozoa. To by znamenalo, že expanze stavebních plánů živočichů (paleontologie například mluví o takzvané kambrické explozi) není vysvětlitelná prostým zmnožením homeoboxového genu procesem opakovaných duplikací, ale spíše, že takovéto vytvoření klastru poskytlo platformu pro nějaké jemnější a sofistikovanější procesy, které v tuto chvíli můžeme pouze předpokládat. Paralelně dokonce mohlo docházet ke snižování počtu homeoboxových genů v klastru.
Zmnožení (zčtveronásobení) základního klastru u pokročilých druhoústých může být dáno spíše částečným zmnožováním chromozomové sady a nestojí u zrodu této linie, neboť u primitivních typů strunatců (kopinatec plžovitý [Branchiostoma lanceolata]), stejně jako u ostnokožců je pouze jeden Hox klastr. Na druhou stranu však vícenásobný výskyt jednotlivých homeoboxových genů snižuje u pokročilejších druhoústých frekvenci fenotypových projevů homeotických mutací a jistě tedy také mohl mít vliv na evoluci stavebních plánů.
Bylo by jistě žádoucí, kdyby se potvrzení dichotomie evoluce prvoústých do dvou základních vývojových linií (Ecdysozoa a Lophotrochozoa) na základě odlišnosti dvou prototypů skupin homeoboxových genů ze zadní části anterioposteriorní osy promítlo ve výběru dalších organismů do programů sekvenování genomu. Ve skupině druhoústých bylo a je studováno hned několik modelových organismů - myš, člověk (projekt HUGO), drápatka, danio, ježovka. Ecdysozoa jsou zastoupena octomilkou a Caenorhabditis elegans. Ve skupině Lophotrochozoa takový model chybí a je otázkou, zda by mezi další projekty sekvenování něměl být vybrán genom například nějakého měkkýše.
Velká pozornost byla věnována objasnění role genu Ultrabithorax na utváření stavebního plánu hmyzu, jmenovitě na vzniku zadečku - části těla, která je, na rozdíl od situace u ostatních "Panarthropod" (členovců spolu s drápkovci a želvuškami), bez končetin.
Gen Ultrabithorax například negativně reguluje gen homothorax (morfogeneze tykadel), dále gen SRF (vývoj "plochy křídla"), aktivuje gen pro signální molekulu decapentaplegic a způsobuje represi genu distal - less, který je hlavním genem řídícím morfogenezi končetin. Právě vazba na enhancer genu distal - less, označovaný Dll304, a jeho represe je vlastní jen hmyzímu proteinu ultrabithorax, zatímco schopnost regulovat všechny ostatní vyjmenované geny sdílí s tímto proteinem i jeho homology jak z drápkovce tak z korýšů. Represe vazebného místa Dll304 tedy vyžaduje nějaký doplňkový motiv na molekule hmyzího ultrabithorax. Ve skutečnosti existují takové motivy hned dva. Na rozdíl od drápkovce nese C-koncová oblast hmyzího ultrabithorax takzvaný QA motiv, reprezentovaný sekvencí QAQAQK a následovaný řetězcem alaninů. Tento motiv samotný je při uměle zkonstruovaném spojení se zbytkem sekvence ultrabithorax z drápkovce schopen blokovat vývoj končetin stejně, jako by se jednalo o původní ultrabithorax z octomilky (Drosophila).
Složitější je však situace u korýšů. Jejich ultrabithorax má s hmyzím proteinem shodnou jinou sekvenci (nepřítomnou u drápkovce), která také dokáže reprimovat Dll304 . Přesto u korýšů exprese genu Ultrabithorax nebrání vývoji končetin. Je to proto, že C-koncová část jejich proteinu ultrabithorax nese řadu serinů a threoninů. Předpokládá se, že tyto seriny a threoniny interagují s motivem odpovědným za represi Dll304 a blokují ho, čímž mu brání v inaktivaci genu distal - less. K vývoji končetin potom může dojít. Během evoluce hmyzu byla zřejmě sekvence serinů a threoninů postupnými mutacemi eliminována a nakonec nahrazena druhou, již zmíněnou, Dll304-reprimující doménou s QA motivem a alaniny.
Právě to, že že se jedná o sekvenci více serinů a threoninů, které mohly být během evoluce mutovány postupně, může mít zásadní význam. Inhibice motivu reprimujícího Dll304 potom také mohla být částečná, snižující se s počtem mutací serinů a threoninů
Z pohledu stavebního plánu to mohlo znamenat postupné ubývání končetin na (budoucím) zadečku. A to by zase, na rozdíl od skokové přestavby, umožňovalo neustálé vylaďování interakce měnících se organismů vývojové linie se svou ekologickou nikou:
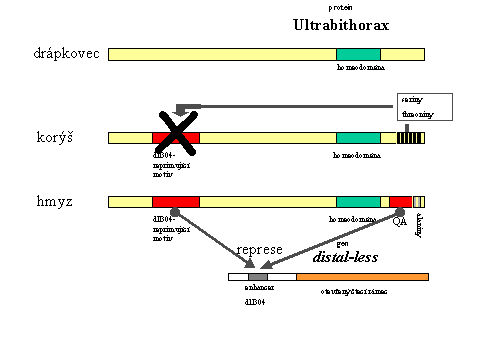
Celý problém je pravděpodobně o trochu složitější: Na represi pomocí interakce s 197 párů bazí dlouhou sekvenecí z enhanceru Dll304, která je skutečným represorem v nejužším smyslu (a začala být označována "negativní regulační element komplexu Bithorax" - "NRE-BX"), se kromě proteinu ultrabithorax podílejí zřejmě i proteinové produkty obou zbývajících genů z tohoto komplexu - abdominal A a B.
Na druhou stranu distal - less a další již vyjmenované geny, které se účastní v morfogenezi, nejsou jedinými geny, které jsou proteinem ultrabithorax regulovány. Krom nich jsou jeho cílovými místy geny apterous (kóduje transkripční faktor), gen 18wheeler a také gen pro membránový protein connectin. Ten je přítomen na povrchu některých svalových buněk octomilky (Drosophila) a na zakončeních neuronů, které je inervují.
Grafika: Martina Hanáková