Nejčastěji používaným materiálem na ortopedické implantáty je titan. Používá se samotný i jako slitina. Má dostatečnou mechanickou pevnost a přitom je chemicky stálý. Nekoroduje a neprovokuje imunitní aparát, takže alergické reakce na něj prakticky nejsou. To, že se proti němu tělo nebouří ale ještě neznamená, že je vše v pořádku. Ortopédi to dobře znají, že u náhrad kyčelních kloubů nejde jen o to natlouci pacientovi do stehenní kosti kus kovu s novou hladkou hlavicí, ale že je potřeba, aby se náhradní díl nezačal v kosti časem viklat. Stává se, že některým pacientům umělé klouby „nesednou“ a začnou problémy s nezvládnutelnými infekcemi a implantát musí pryč. Podobné případy se stávají v jednom až dvou procentech případů. Je nasnadě, že týmy inženýrů se snaží najít způsob, jak povrch implantátů upravit, aby se rizika spojená s jejich „odhojováním“ snížila.

Přesto, že se implantáty všemožně vylepšují, například zdrsňováním povrchů broušením, laserovým vypalováním mikrokomůrek (nanostrukturováním), pokrýváním povrchu polymery (dendrimerry), keramickou vrstvou,... to vše se dělá aby se na nich kostní a jiné buňky cítily dobře. Přes veškerou snahu se problém přechodu implantát-kost zatím zcela vyřešit nepodařilo. Buňky našeho těla jsou až moc dobře vycvičené na rozeznávání cizího a vlastního. Žel to uplatňují i tehdy, kdy se nám to nehodí, což dělá implantáty náchylné pro vznik zánětu. Tam, kde je zánět, se začne dařit patogenům. A kde jsou patogeny, tam se schyluje k velkému problému a je potřeba nasadit antibiotika.
Antibiotika jako zbraň v boji proti patogenním bakteriím pomalu ztrácejí účinnost. Například kmen Staphylococcus aureus byl ještě kolem roku 1950 úspěšně ničen penicilinem. Teď už na tu dobu můžeme jen nostalgicky vzpomínat. Téměř všechny jeho kmeny jsou proti němu rezistentní. Za tento stav si bohužel můžeme z velké části sami. Do objevu penicilinu (Fleming, 1941) se běžně umíralo i na zcela banální infekce, proto se antibiotika, jako zázračné léky, začala přidávat takřka do všeho, třeba i do zubní pasty. Byla to chyba. Tu už teď neděláme, ale zato se dopouštíme jiných přehmatů, kterými vznik rezistentních kmenů podporujeme. K takovým se řadí léčba infekcí spojených s ortopedickými implatnáty. Jak vědci nyní prokázali, přichází se s ní pozdě a nevhodně.
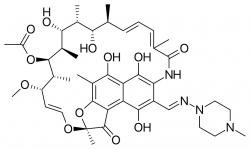
Tradiční terapie spočívá v kombinaci širokospektrálních antibiotik, převážně rifampicinu (v USA známý pod označením rifampin). Jde o semisyntetický produkt izolovaný z plísně Amycolatopsis rifamycinica. Tento lék je již 50 let starý a původně byl určen k léčbě tuberkulózy a lepry, nicméně stále dobře zabírá na celou řadu úporných bakteriálních infekcí, včetně stafylokoků získaných punkcemi ze zánětlivých ložisek v kostech. Problém je v tom, že co zabírá v testech citlivosti na Petriho miskách, v praxi nefunguje. Zakopaný pes je v nedostatku informací. U implantantátů, například těch zarážených do dutých kostí jsme prakticky bez informací, co se na jejich povrchu a v přilehlé kosti děje. Až dosud jsme nebyli schopni určit, kolik rifampicinu se do cílového místa dostává. Je zbytečné dodávat, že když se do postiženého místa antibiotika nedostává dost, že to i s účinností léčby je na levačku. A nejen to. Ještě horší je, že si tím zaděláváme na vznik kmenů, na něž pak i jakékoliv prodlužování léčby a zvyšování dávek, začne být krátké.
Stejně tak by bylo nošením dříví do lesa zde rozebírat, jak přetrvávající zánět vede k remodelaci kosti a laicky řečeno, i to, co nám tam chirurg poctivě nabouchal kladivem, stejně začne kloktat. Takové dráždění vikláním situaci dál zhoršuje a hlavně bolí. Neobejde se to pak bez reoperace. Ani ta už do zánětem postižené kosti nemusí přinést kýžený výsledek.
Popsaných problémů si jsou lékaři dobře vědomi. Proto také ordinují dlouhodobé podávání antibiotik. Standardně se doporučuje 6týdenní kombinovaná léčba (s vankomycinem) s dávkami rifampicinu 10 až 15 mg/kg/den. Výzkumníci z Johns Hopkins University School of Medicine se zamysleli nad tím, proč to nestačí. K vizualizaci toho, co se na implantátech děje, je napadlo využít zobrazovací techniku PET, neboli pozitronovou emisní tomografii. Byla to šťastná volba. Ukázalo se, že se tím přítomnost bakterií v zánětlivém ložisku dá zjišťovat. Protože by jim zaměstnavatel dělat pokusy na lidech nepovolil, uchýlili se ke spolupráci se čtyřnohými dobrovolníky z řad hlodavců. Díky pokusům na myších se podařilo odhalit, že rifampicinu do kosti proniká jen asi 14 %. Tedy pouhá třetina toho, co se předpokládalo. S takovým zjištěním už člověk nemusí být genius, aby ho napadlo změnit způsob stávající léčby, což také tým odzkoušel.
Vedoucí výzkumu profesor pediatrie a radiologie Sanjay Jain uvádí, že teprve až trojnásobnou dávkou (než je ta nynější doporučená), se jim podařilo dosáhnout požadované likvidace bakterií v zánětlivých ložiscích. Standardní šestitýdenní léčba (s 10 až 15 mg/kg/den) se tedy neukázala být tím pravým ořechovým. Lepších výsledků lze dosáhnout čtyřtýdenní kůrou s vyššími dávkami rifampicinu. Bonusem kratší a razantnější léčby je, že tak snadno nevznikají mutantní kmeny, které si pak i z dalších antibiotik dělají šoufky (v tomto případě vankomycinu). Dobrou zprávou také je, že odzkoušené vyšší dávky rifampicinu (35 mg/kg/den) jsou i pro člověka stále ještě bezpečné.
Závěr
I když se většinou nechováme jako zvířata, vědci jsou toho názoru, že co se týká stafylokokových biofilmů na implantátech mezi námi rozdíl není, a že razantní přístup k infekčním komplikacím u ortopedických implantátů může změnit život k lepšímu celé řadě trpících.
Literatura
Oren Gordon et al, Dynamic PET-facilitated modeling and high-dose rifampin regimens for Staphylococcus aureus orthopedic implant–associated infections, Science Translational Medicine (2021). DOI: 10.1126/scitranslmed.abl6851