Účinky s prahem a bez prahu
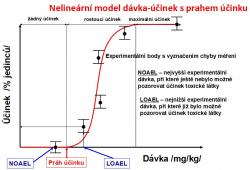
Duchovní otec toxikologie Paracelsus (1493-1541) údajně pravil: Sola dosis facit vevenum – tedy jedině dávka rozhoduje o tom, zda je látka jedovatá či nikoli. Z daného postulátu vyplývá, že pro každou látku by měla existovat prahová dávka, pod níž je daná látka zdraví neškodná. Snahou zákonodárců by pak mělo být regulovat zacházení s chemickými látkami tak, aby nedocházelo k překročení takové dávky. Klasickým způsobem, jak odhadnout míru bezpečné expozice je tzv. NOAEL/UFs postup. NOAEL (zkratka pro No-Observed-Adverse-Effect-Level) je nejvyšší dávka, která v průběhu toxikologického experimentu na laboratorním zvířeti ještě nevyvolala pozorovatelný toxický účinek. Parametry UF (Uncertainty Factors) mají obvykle hodnotu 10. Jejich smyslem je korigovat vliv mezidruhové variability (např. rozdíl mezi potkanem a člověkem), vnitrodruhové variability (rozdíl zdravého dospělého muže a malého dítěte či nemocného seniora), délky studie apod. Při výpočtu akceptovatelného denního příjmu látky (ADI-Acceptable Daily Intake) hodnotu NOAEL podělíme součinem všech faktorů UF. Takto vypočtená dávka by nám pak měla zajistit, že nám příslušná látka nezpůsobí zdravotní obtíže, ani když jejím účinkům budeme vystaveni každodenně po celý život.
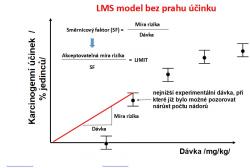
Podíváme-li se však na obvyklé způsoby, jakými je regulováno nakládání s genotoxickými karcinogeny, můžeme dojít k závěru, že pro tuto skupinu látek Paracelsův postulát neplatí. Vyvolání vzniku nádoru působením karcinogenu v rámci toxikologického experimentu obvykle vyžaduje dlouhodobou (celoživotní) expozici a díky přirozené tumorogenezi často nebývá rozdíl v četnosti nádorů mezi pokusnou a kontrolní skupinou nijak vysoký. Dosažení dostatečně vysoké statistické síly prováděných testů (tedy redukce pravděpodobnosti falešně negativních výsledků) tak vyžaduje práci s nepřiměřeně vysokými dávkami testované látky, protože jen ty jsou schopné vyvolat pozorovatelné a statisticky významné zvýšení četnosti nádorů. Velkou neznámou pak ovšem zůstává, jaké klíčové biochemické děje (key events) se skutečně odehrávají v oblastech nižších dávek. V souladu s principy předběžné opatrnosti tak bývají k popisu vztahu dávka-účinek používány konzervativní modely zajišťující co největší míru bezpečnosti. Podstatou těchto modelů (např. LMS – Linearized Multistage) je představa, že práh účinku neexistuje a že vztah mezi nízkou dávkou genotoxického karcinogenu a pravděpodobnosti vzniku chemicky indukovaného nádoru lze nejlépe popsat pomocí přímky, která protíná počátek soustavy souřadnic. Pokud však neexistuje práh účinku, bude každý kontakt s látkou představovat riziko a regulační limit pak musí být nastaven nikoli jako bezpečná dávka (tedy dávka nevyvolávající toxický účinek), ale jako dávka, která zvyšuje riziko vzniku toxického účinku o zvolenou hodnotu (obvykle jde o dávku, která v populaci čítající 1 milion lidí zvýší počet nádorů vzniklých během celého života o 1 případ). Neexistence prahu účinku je však spíše důsledkem nízkého stupně pochopení dějů vedoucích ke vzniku nádoru než popisem biologicky relevantní skutečnosti. Pojďme si teď přiblížit příklady genotoxických karcinogenů, u nichž byla představa o neexistenci prahu účinku alespoň částečně zpochybněna.
Formaldehyd
Formaldehyd je vysoce reaktivní těkavá kapalina, jejíž páry jsou dobře rozpustné ve vodě. Při průchodu nosní dutinou je plynný formaldehyd rychle absorbován v buňkách epitelu. Chronická inhalační expozice dávkám vyšším než 7 mg/m3 vyvolala u laboratorních potkanů (kmen Fischer 344) karcinom nosních dlaždicových buněk (SCC – Squamous Cell Carcinoma). Pomocí testů in-vitro prováděných na buněčných kulturách byla jasně prokázána genotoxicita formaldehydu, když byl v jádrech buněk vystavených vysokým dávkám látky pozorován výskyt velkého množství křížových vazeb mezi DNA a proteiny (DPX - DNA-protein crosslinks). Formaldehyd je ale rovněž cytotoxický a v dávkách mnohem nižších, než při jakých byl pozorován vznik DPX, způsobuje kompenzační proliferaci buněk (compensatory CRCP – Cytolethal-Regenerative Cell Proliferation). Pokud rychlost kompenzační proliferace převýší rychlost, s jakou opravné mechanismy odstraňují přirozeně se vyskytující chyby v DNA, může docházet k fixaci těchto mutací. Zatímco mutagenní účinek spojený s tvorbou DPX může záviset na dávce lineárně a nemusí mít zjevný práh účinku, v případě kompenzační proliferace vyvolané cytotoxickým účinkem látky lze nejspíše předpokládat nelineární závislost dávka-účinek s prahovou hodnotou. Klíčovou otázkou v procesu analýzy rizik tedy bude, který z obou zmíněných procesů se na vzniku karcinomu nosních dlaždicových buněk podílí nejvýznamněji. A nejen to – bezprahový lineární vztah mezi dávkou formaldehydu a vznikem DPX byl pozorován při testu in-vitro, ale v komplexním živém organismu lze předpokládat vliv toxikokinetických jevů (např. saturace metabolické kapacity tkání), které mohou zjednodušenou představu o bezprahovém účinku velmi zkomplikovat.
Spojením toxikokinetického modelu, popisujícího pohyb formaldehydu dýchacími cestami potkana (CFD – Computational Fluid Dynamic) a farmakokinetického modelu popisujícího rychlost metabolismu formaldehydu a následně pak vztah mezi koncentrací formaldehydu v určitém místě dýchacích cest a tvorbou DPX či indukcí kompenzační proliferace byl vytvořen tzv. biologicky-podložený model dávka-účinek (BBDR – Biologicaly Based Dose Response). Výstupy daného modelu ukázaly, že cytotoxický efekt spojený s kompenzační proliferací má na vznik nádorů u hlodavců mnohem větší vliv, než přímý genotoxický účinek doprovázený tvorbou DPX. Křivka dávka-účinek ve tvaru J (tzv. hormezní křivka) získaná s využitím BBDR byla schopna popsat výsledky řady in-vivo studií lépe, než bezprahový lineární model. Odhad nárůstu počtu případů rakoviny dlaždicových buněk u lidí, kteří budou celoživotně denně vystaveni koncentraci 25 ug/m3 formaldehydu (20 ppb) se s použitím BBDR modelu pohyboval okolo 9.7 E-07, přičemž lineární bezprahový model poskytoval hodnoty 330-krát vyšší. Aplikace modelů respektujících skutečnou povahu dějů vedoucích ke vzniku nádoru tedy může vézt k zásadní změně v odhadu rizika a následně může pomoci optimalizovat náklady na různá preventivní opaření, jejichž cílem je ochrana zdraví exponovaných osob.
Šestimocný chróm
V rámci amerického National Toxicology Program byla v roce 2008 na potkanech (kmen F344) a myších (kmen B6C3F1) provedena 2-letá studie karcinogenních účinků Cr(VI) v pitné vodě. Potkani pijící vodu o koncentraci Cr(VI) 180 mg/L vykazovali zvýšený výskyt tumorů v ústní dutině a u myši se zase při koncentracích 30 mg/L a vyšších vyskytovaly nádory tenkého střeva. Výsledky druhého z experimentů pak byly americkými regulačními orgány použity v rámci bezprahového lineárního modelu (LNT – linear no threshold) dávka-účinek k výpočtu bezpečné koncentrace Cr (VI) ve vodě. Limit, který má při celoživotní konzumaci zajistit, že nárůst nových případů rakoviny bude nižší než 10E-6, byl stanoven na hodnotu 0,02 ug/L. To je 50-krát méně, než je na území USA typická koncentrace Cr(VI) v pitné vodě. Podobně jako v případě formaldehydu, i pro Cr(VI) existovaly pozitivní výsledky in-vitro testů mutagenity (např. Amesův test na bakterii Salmonella typhimurium), které zavdávaly důvod pro použití bezprahového modelu pro popis vztahu dávka-účinek.
Nádory tenkého střeva mají nejčastěji původ v mutacích DNA pluripotentních kmenových buněk v Lieberkühnových kryptách. Také v případě Cr(VI) vyvstala otázka, zda je při testovaných dávkách toxický iont distribuován v této kritické tkáni a pokud ano, zda zde vyvolává mutace DNA. Na první otázku pomohla odpovědět aplikace synchrotronové rentgenfluorescenční mikroskopie (synchrotron-based XRF microscopy), což je moderní zobrazovací metoda schopná s vysokým prostorovým rozlišením analyzovat distribuci prvků ve tkáních. Pomocí této metody byly vyšetřeny vzorky tenkého střeva myší, jimž byla po dobu 90 dní podávána voda s obsahem Cr (VI) 180 mg/L. Klky střevní sliznice sice obsahovaly zvýšené koncentrace sledovaného prvku, ale v kryptách byla jeho koncentrace pod detekčním limitem metody. Mikrojaderný test, který je schopen prokázat nevratné poškození DNA, byl v případě buněk odebraných z Lieberkühnových krypt takto exponovaných myší rovněž negativní. Testy na transgenních myších (Big Blue rats F344) pak posloužily při hledání odpovědi na druhou otázku. Tyto testy prokázaly, že Cr (VI) nevyvolává pozorovatelné mutace v buňkách ústní dutiny, ani při expozici vodě obsahující 180 mg/L tohoto iontu po dobu 28 dní. Aktuálně se tedy zdá, že Cr(VI) je poměrně slabý mutagen, který při perorálním podání ve vysokých (cytotoxických) koncentracích vyvolává nádory cestou masivního poškození zasažené tkáně, v níž náhodně přežívají buňky s poškozenou DNA. Tento mechanismus však pravděpodobně rovněž vykazuje práh účinku. Aplikace modelu s prahem by samozřejmě nutně musela vést k podstatnému navýšení limitu Cr(VI) v pitných vodách.

A závěr?
Vývoj našeho porozumění biologickým mechanismům, jimiž toxické látky vyvolávají vznik nádorů, a rozšiřující se možnosti analytických a diagnostických metod se nutně musí odrazit i na optimalizaci postupů analýzy environmentálních a zdravotních rizik chemických látek. Distribuční bariéry, které v komplexním organismu brání průniku toxické látky na místo účinku, stejně tak jako detoxikační metabolické a reparační procesy ovlivňují odezvu na toxickou látku a nemohou být v procesu analýzy rizik ignorovány. Samozřejmě, že někdy aplikace takových postupů může vést i ke zmírnění nesmyslně přísného limitu pro určitou toxickou látku, což nutně vyvolá otázky týkající se etické oprávněnosti takového postupu. Na druhou stranu, vyvolávání obav z neexistujícího rizika má rovněž svá etická úskalí…..
Literatura
-
Clewell, R. A., Thompson, C. M., & Clewell III, H. J. (2019). Dose-dependence of chemical carcinogenicity: Biological mechanisms for thresholds and implications for risk assessment. Chemico-biological interactions 301, 112-127.