Klíčovou roli při vyšetřování nádorů hraje biopsie. Míní se tím zákrok, při němž chirurgové, při klasické operaci, nebo pomocí endoskopu opatřeného klíšťkami, eventuálně vpichem speciální dutou jehlou, vyjmou z orgánu kousek tkáně. Podezřelé buňky se pak v laboratoři histologicky a cytologicky vyšetřují, aby se získaly informace o povaze novotvaru, agresivitě zhoubně bujících buněk a riziko tvorby metastáz. Řada rakovin má své typické podpisy v podobě genové a proteinové exprese. Pomocí těchto značek onkologové stanovují diagnózu a sestavují indexy prognózující běh věcí příštích a jsou vodítkem k zahájení léčby, její změně, případně ukončení.
Včasné odhalení a volba léčby, jsou pro přežití rakoviny, to zásadní. U orgánů, jako již zmíněné plíce, slinivka, je problém získat vzorky tkáně. I když klasická biopsie (tou zde míníme chirurgickou) má své výhody, například poskytuje reprezentativní a dostatečný počet buněk k provedení testů a podává ucelený obraz probíhajících dějů, naráží na problém odběru a jeho opakovatelnost. Řezat, nebo píchat do plic, jen proto, že se nám něco nezdá, nemusí být tím nejlepším řešením. Jednak se tím zvyšuje riziko, že se v ráně začne dařit infekci, a také se tím zvyšujeme riziko, že se zákrokem uvolněné nádorové buňky roznesou a dají vznik druhotným ložiskům. Často se proto s odběrem vzorků váhá. Neznalost optimální léčby má až moc často na triku, že nás rakovina předběhne. Aby k tomu nedocházelo, hledají se neinvazivní vyšetřovací metody.
Hitem poslední doby se stala „tekutá biopsie“ (někdy označovaná jako "kapalná biopsie"). Provádí se vyšetřením krve a využívá se při ní toho, že i nádorové buňky hynou, rozpadají se a svou DNA uvolňují do krevního řečiště. Normálně je DNA v buňce (v buněčném jádře), jakmile se ale začne jen tak volně potulovat, rychle je z krve eliminována. Tím, že se rakovinové buňky často množí překotně, recyklační aparát je všechny nezvládá likvidovat. Tekutá biopsie využívá právě oněch poflakujících se útržků genetického kódu. Protože jde o vyšetřování DNA, která není v buňce, začalo se jí říkat „bezbuněčná“. V překladech (nejen do češtiny) se až příliš často setkáváme s termínem „nebuněčná DNA“, což je špatně, ale bez ohledu jaký termín se pro ní nakonec ujme, je takové vyšetřování přínosem. Má ale háček. Koncentrace molekul nukleových kyselin původem z nádorových buněk je v krvi velmi nízká a těžko se odlišuje od pozadí. Pozadím se tu míní normální nezmutované molekuly, původem ze ze zdravých buněk, neboť i ty nám občas v těle uhynou. Těch zdravých buněk je v začátcích rakoviny v těle, naprostá převaha a tento nepoměr činí tekutou biopsii metodou poněkud nespolehlivou.
Když to zjednodušíme, tak se jedná o techniku schopnou pracovat s nepatrným množstvím DNA a dovolující tzv. časný záchyt rakoviny. Jen málo nám ale řekne o tom, co se s nádorem v těle děje a původní očekávání nesplňuje. Je u ní potřeba mít vždy na mysli, že počet nádorových buněk a jejich DNA, které přechází do krve, je malý. Uvádí se, že jen asi 0,01 % cirkulujících nádorových buněk představuje buňky schopné dát vznik metastatickým ložiskům a jejichž DNA se dá rozlišit od běžných cirkulujících imunitních buněk. Laicky řečeno, při hledání jehly v kupce sena kapalnou biopsií, je potřeba mít hodně štěstí. A i když ho máme, z výsledku nelze soudit, jak moc jehel tam ještě je, ani jak jsme s léčbou úspěšní.
Před několika dny kolektiv Američanů z Michiganu a Detroitu popsal metodu, která nastíněné problémy biopsií eliminuje. Jak té klasické založené na dloubání se do orgánu, tak i té tekuté s omezenou vypovídací hodnotou. U tekuté biopsie se klade důraz na schopnost zjistit přítomnost zvrhlého ložiska z několika málo molekul ve vzorku. Nynější novinka jde na problém z opačného konce. Jejím základem je vychytávání podezřelého materiálu na jakousi pomyslnou hromádku. Teprve až je v pasti dostatek substrátu, přistoupí se k provedení testů. Nejen, že se s dostatkem materiálu pracuje snadněji, ale hlavně nehrozí falešné výsledky.
Kladení pastí
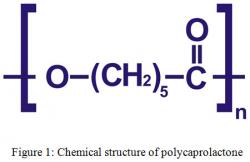
V publikaci autoři uvádí, že jako past použili „porézní PCL“. To je moc dobrá zpráva, protože nejde o nic zvláštního. Konkrétně jde o poly ε-kaprolakton, tedy levný biodegradabilní a biokompatibilní kopolymer. Do medicíny si před časem našel cestu v poněkud zakuklené formulce „inteligentní hydrogely“. Jejich specialitou je uvolňování účinných látek v závislosti třeba na pH, teplotě teplotě,… Zdravá část populace má šanci se s kaprolaktonem setkat například ve specializovaných obchodech, kde se dbá na to, aby se u prodávaných náhražek patřičně skloubila tuhost s poddajností i vlastnostmi jemné sliznice (název neuvádíme, neboť bdělé Google oko by nás opět penalizovalo).

V našem případě vědci využili jakési dvojakosti kopolymeru. I když se o něm v lékařské literatuře píše, že je organismem tolerován, není to tak docela pravda. Přece jen je pro tělo cizincem, a tím pádem na sebe láká pozornost imunitního systému. Nejde vyloženě o boj, jen o jakési šikování bílých krvinek, „pro všechny případy“. V tomto případě se tento vedlejší efekt ukázal být velice žádoucí. O bílých krvinkách je totiž známo, že přitahují (váží na sebe) buňky, které se jim z nějakého důvodu nezdají. Hydrogel tedy funguje jako past, v níž se kumulují, jak zdravé imunitní buňky, tak i ty zvrhlé (rakovinové). Jak si řekneme později, obojího je třeba, pokud chceme dobře poznat, co se v pacientově těle děje. To co autoři studie nazvali implantačními pastmi, je něco, co připomíná knoflíčky od košile. Jen to je menší (průměr půl centimetru, tloušťka dva milimetry) a těch dírek v tom je mnohem víc. Aby se v pastičkách buňkám co nejvíc líbilo, jsou „samá díra“ (velikost pórů: 250 - 425 mikrometrů).
Vlastní kladení pastí také není žádná věda. Dávají se pod kůži a zákrok připomíná čipování. Teoreticky je lze umístit kamkoliv, ale protože testování probíhalo na myškách, kvůli snadnému přístupu, zvolili vědátoři záda. Vkládali jich pod kůži každému pacientovi rovnou několik. To aby při jejich postupném vyjímání (v týdenních intervalech) umožňovalo průběžně zjišťovat, jak se po odstranění primárního nádoru, rakovině v těle daří, respektive nedaří. Vlastní vyšetření v praxi vypadá tak, že se jedna z pastí vyjme a dá na stůl genetikovi, nejlépe imunogenetikovi, ten ze zachycených buněk toho dovede vyčíst nejvíc. V tomto případě nešlo ani tak o přítomnost genů, jako o to, zda a jak moc, jsou rakovinové geny v buňkách funkční (spuštěny). Na jaké obrátky ten který gen se dá zjistit oklikou. Stačí si vzít do parády ze vzorku nikoli DNA, ale RNA. Ta totiž svědčí o tom, jak moc povelů zapsaných v DNA vysílá jádro do cytoplazmy a jak se podle příkazů buňka chová (včetně toho, jaké si vytváří na svém povrchu pracovní nástroje - receptory).
Prvním krokem v laboratoři je tedy z „pasti“ izolovat RNA. Tu pak pomocí enzymu (reverzní transkriptáza) přepsat do DNA (deoxyribonukleové kyseliny). Zdá se to poněkud nelogické, když se izoluje něco, co je ve vzorku také přítomno. Proč se taková krkolomnost provádí, vyjde najevo, až když si uvědomíme možnosti techniky, v hantýrce nazývané RT-qPCR. Jde o udělátko, které nejen, že dělá podle RNA molekuly komplementární molekuly DNA, ale protože získanou DNA množí pomocí polymerázové řetězové reakce, stačí dodávané stavební kameny označit fluorescenční barvičkou a hned tím (podle toho jak moc vzorek svítí) získáme informaci o genové expresi daných úseků (genů DNA). Laicky řečeno - jak moc rakovinových buněk koluje pacientovi v těle i jakého jsou ty buňky typu (podle skladby spuštěných genů). Vědci v pokusu sledovali více než 600 genů. Zhruba stovka jich se u nemocných rakovinou projevila podstatnými změnami. Těch s vysokou vypovídací hodnotou, bylo ale jen asi deset a z nich polovina signalizovala přítomnost metastáz.
Že nová metoda funguje v praxi, si vědci ověřili na pokusech se živými zvířaty. Rakovinu jim přivodili transplantací rakovinové tkáně. Následně u nich sledovali jejich zdravotní stav. Důležité na tom je, že buňky získané pomocí pastí, dávaly stejný obraz vývoje rakoviny, jaký vědci získali pomocí rozborů buněk získávaných klasickou biopsií (což se o metodě tekuté biopsie, říci nedalo). U pastí ale nejde jen o záchyt agresivních nádorových buněk indikujících vznik metastáz, ale i zdravých buněk imunitního systému. I ty lze informačně vytěžit. Geny řídící povrchové antigeny na buňkách dávají představu o aktivaci imunitního systému. Převedeno do lidštiny, signalizují odhodlání lymfocytů, makrofágů, dendritických buněk, zkřížit zbraně se zvrhlými buňkami a jdou léčbě s cytostatiky, radioterapií,… takzvaně naproti. Když to shrneme, tak zavedením metody do rutiny by se projevilo v časnějším záchytu nemocných. U pacientů již léčených, by dříve potvrdila remisi i recidívu. Ošetřující lékař by měl dříve jasno v tom, kdy může léčbu omezit a dopřát pacientovi čas na zotavení, a kdy je naopak potřeba „přitvrdit“.
Závěr
Vyšetřovací metoda „kladení pastí“, popsaná v nejnovějším čísle odborného časopisu Cancer Research, má všechny předpoklady ukázat své přednosti i v klinice a vylepšovat vyhlídky nemocných s rakovinou orgánů, odkud se vzorky tkáně k vyšetření získávají obtížně a s velkým rizikem pro pacienta. .
Literatura
Robert S. Oakes, et al.: Metastatic citioning of myeloid cells at a subcutaneous synthetic niche reflects disease progression and predicts therapeutic outcomes, Cancer Research (2019). DOI: 10.1158/0008-5472.CAN-19-1932
Philipp Jurmeister et al.: Machine learning analysis of DNA methylation profiles distinguishes primary lung squamous cell carcinomas from head and neck metastases, Science Translational Medicine (2019). DOI: 10.1126/scitranslmed.aaw8513