Kdo je vědec přezdívaný „čínský Frankenstein“?
Dr. Jiankui He je biofyzik, který se narodil v Číně, tam také získal vysokoškolské vzdělání na univerzitě v Anhui. Díky stipendiu se dostal na Rice University (USA), kde získal doktorát. Jako tzv. postdok působil na Stanfordské univerzitě. Zpět do Číny se vrátil v rámci Pekingského plánu "Tisíce talentů", který si klade za cíl odvracet únik mozků do zahraničí. Dostal místo docenta na katedře biologie prestižní Jižní vědecko-technologické univerzity v Šen-čenu (SUSTech).
Co provedl?
Věnoval se párům, v nichž muž byl HIV pozitivní a žena neinfikovaná. Mužům odebral sperma, ženám vajíčka a prováděl s nimi oplození in vitro, aby mohli mít potomky. Některým nabídl upravit dědičnou informaci potomka tak, aby v budoucnu nemohl infekcí HIV onemocnět, přičemž se odolnost bude dědit i na jejich další pokolení. Jde tedy o změnu, která nenapravuje vrozený dědičný defekt, ale dodává člověku vlastnost, kterou po rodičích nezdědil a kterou lze považovat za pozitivní dědičný rys.
Ne vše je ale tak jednoznačné, a tak se proti němu vzedmula vlna celosvětového odporu. Ve vyjádření mateřského univerzitního pracoviště se praví, že vědec jednal na vlastní pěst a že ho vedla vidina slávy a zisku, což je v Číně velmi opovrhovaný osobnostní rys.
Ve zprávě vyšetřovací skupiny zřízené Čínskou zdravotnickou komisí v provincii Guangdong vydané 21. ledna 2019 se uvádí, že čin je v rozporu s vládními zákazy a že nezákonný projekt uskutečnil se zahraničními spolupracovníky. Což je také přitěžující formulace.
I když zmíněné zahraniční spolupachatele předběžná zpráva nezmiňuje, nejspíš se bude jednat o Michaela W. Deema. Doktorandského školitele z doby, kdy byl Jiankui součástí týmu na Rice University. Jiankui s Deem spolupracoval i po svém návratu do Číny. Deem se zapojil i do jeho čínského klinického projektu a účastnil se jednání s páry zapojenými do studie v době, kdy od nich byl získáván k zákroku souhlas.
Druhým Američanem by mohl být Dr. William Hurlbut ze Stanfordu, u něhož Jiankui pracoval a který byl s čínským vědcem v době provádění výzkumu rovněž v kontaktu a zákrok spolu prokazatelně konzultovali. Možná ale jde i o Stephena Ronalda Quaka, třetího amerického vědce. Tento absolventovi Stanfordu s doktorátem z Oxfordu s postem vyšetřovatele lékařského institutu Howarda Hughese. Tento volený představitel Národní akademie věd (USA), se pro časopis Science vyjádřil slovy „I certainly do not approve, of what he did...“. K jeho smůle se ale zachovala korespondence, z níž vyplývá něco jiného. Například, že Jiankuimu k úspěchu sděluje: „Wow, that is quite en echievement!...“.
Když to zkrátíme, tak jakmile se veřejné mínění a řada odborníků začala k čínskému pokusu vyjadřovat kriticky, Američané se, jako jeden muž, od svého kolegy distancovali, a jak jeden z nich uvedl: „Netušili, že to opravdu provede“.
Poněkud zavánějící je i vyjádření čínské univerzity. Je obtížné si představit, že by u tak dlouho probíhajícího projektu s klinickou aplikací, výzkumník (Jiankui He) nemusel formulovat cíle své práce, skládat účty z činnosti a průběžně nevykazovat, čeho již dosáhl. Z oficiální zprávy ale vyplývá, že zástupci v orgánech, jako je „vědecká rada univerzity“ neměli ani tušení, co dělá, že vše podnikal jen „na vlastní pěst“ a nikoho o tom neinformoval.
Co na to říká Jiankui?
K dispozici jsou jen jeho vyjádření ze začátku aféry, než k jeho pokoji byla postavena uniformovaná stráž a než jakoby zmizel ze světa. Tehdy tvrdil, že jeho výzkum byl řádně schválen univerzitními autoritami. Podporován byl prý proto, že v Číně v poslední době razantně rostou počty nakažených HIV. Jeho spolupracovník také vypovídal v jeho prospěch a potvrdil, že i nemocné páry rozhodnuté mít děti byly o všem, tedy i riziku z toho plynoucích, řádně informovány.
S odstupem času se dotčené páry, teď již v roli rodičů, začaly rozpomínat, že se jim dostalo informací nedostatečných. Na změně postoje nakažených HIV se nejspíš podepsala i naskytnuvší se vidina odškodného, pokud by případný soud uznal, že byli uvedeni v omyl.
Co je podstatou klinického pokusu?
Změna genu v embryu. Nástrojem, kterým se to dělá, je enzymatický komplex zvaný CRISPR. Pro daný záměr byl upraven tak, aby editoval genom a ochromil produkci imunitního buněčného povrchového proteinu, který virus HIV používá k přichycení, průniku do buňky a který je odpovědný za nastartování infekce. Takové pokusy již dříve byly odzkoušeny na pokusných primátech. Laicky řečeno, z genu kódujícího zmíněný protein se udělá mrzák neschopný problémový protein tvořit.

Embryím, na nichž Jiankui zákrok provedl, odebral asi tři buňky a na těch si pak ověřoval, zda k editaci genů pro protein CCR došlo. Pár, snažící se o potomka metodou IVF pak dostal na vybranou, zda chce implantovat embrya s geny upravenými, nebo embrya „nemodifikovaná“. Z těchto pohovorů se zachovaly nejen protokoly, ale i fotografie, na nichž je i výše zmíněný americký vědec Michael Deem s čínskými klienty.
Jiankuiho kritici poukazují na to, že i když se zákrok provede, není pravda, že je osoba před AIDS chráněna. Mají pravdu, ale jen částečnou. Je k tomu záhodno dodat, že existují formy viru HIV, které pro vstup do buněk používají jiný receptor (ne protein CCR5). Před těmi provedená úprava pochopitelně chránit nemůže. Naštěstí jsou takové formy infekce v menšině.
Jde v pokusu o něco nepřirozeného, a jak mnozí dodávají hraní si na Boha, které nám nepřísluší?
Vlastně ani ne. Stejnou věc už příroda vyzkoušela. Jen na to šla mnohem humpoláčtější metodou zvanou „pokus omyl“, při níž mnozí, kde se jí to nepodařilo, umřeli. Chybovala ale tak dlouho, až se jí jednoho krásného dne mutace, která se osvědčila, povedla. Genetici pro ní zvolili označení „Delta 32“. Jméno má podle chybějícího segmentu 32 párů bází v genu CCR5. To ona nás chrání před infekcí HIV. Moc bychom na tuto mutaci při náhodných setkáních sázet neměli, nosí ji totiž jen asi desetina z nás. Zatímco její rozšíření u severoevropanů je okolo 11 %, Asiaté mají v tomto směru smůlu. U těch je mutace deaktivující „zlý“ protein naprostou vzácností a proto jim AIDS hrozí podstatně víc.
Co se v Číně nepovedlo?
Výhrady se týkají ne zcela přesného napodobení mutace Δ32. V genu pro protein se nepodařilo odstranit všech oněch zmíněných 32 párů bází, jak je tomu v případě přirozené mutace. Jedno z dvojčat má v dané oblasti o čtyři písmena genetického kódu méně a na druhé kopii proteinového genu je jen o jedno písmenko chudší.
Teoreticky by v tom ale nemusel být problém, za jaký se to vydává. Je totiž jedno, zda tvorbě proteinu zabrání výpadek celého segmentu DNA, nebo jen bodový knokaut s jedním vyřazeným nukleotidem.
Další z námitek se týká druhého z dvojčat. U toho se Jinankuimu podařilo vyřadit 15 písmen, ale smůlou je, že jen u jednoho z genů. Protože máme všechny geny (vyjma těch na pohlavních chromozomech) zdvojeny, část buněk těla děvčátka nese neporušenou kopii genu pro protein a bude ho tedy i tvořit. Jinak řečeno, virus HIV dostává šanci se uchytit a vstoupit do buněk. Dívka tedy nebude vůči HIV imunní. Ani v tomto případě by zákrok nemusel být zbytečný a bez efektu. Je tu šance, že by omezení tvorby receptoru dalo imunitnímu systému více šancí se s virovým protivníkem vypořádat, nebo v tom horším případě, průběh a zlý konec choroby oddálit.
Měl čínský vědec k dispozici více možností, jak rodičům pomoci?
Ano měl. Mohl využít techniku tzv. „promýváním spermatu“. Většina virů se tím ze semene odstraní a na vznikající nový život se virus nepřenáší. Jenže je k tomu potřeba dodat, že to není tak jisté a nakažení potomka virem nelze vyloučit. Promývání také potomkům žádnou odolnost při jejich pozdějším setkání s infekcí HIV, nepřinese.
Nejvážnější argument
V neprospěch Jiankuiho počinu svědčí fakt, že enzymatický nástroj CRISPR, který k editaci použil, není neomylný. Někdy střihne i jinde, než se od něj žádá. Nelze tedy vyloučit, že se tak nestalo i v tomto případě. I když se v článcích počínání enzymatického komplexu rádo připodobňuje k neřízené střele.
Z pohledu pravděpodobnosti by i v takovém případě nemusely být následky nijak tragické. Jak známo, většina genomu není moc důležitá. DNA související s tvorbou proteinů (geny včetně kódujících i nekódujících částí, enhancery a silencery) zabírá v lidském genomu ani ne čtvrtinu (uvádí se asi 20 % délky DNA). To nejdůležitější v DNA, tedy části kódující proteiny, zabírají jen asi 3 %. 80 % je tvořeno DNA s nejasnou funkcí a z tohoto množství je přibližně polovina tvořena repetitivními sekvencemi. Zjednodušeně řečeno, pokud se CRISPR utrhl z řetězu a někde provedl něco nekalého, musely by mít děti vyloženě smůlu, protože z hlediska vážného poškození se tu hraje především o ta zmíněná 3 % genomu. Jenže, jak známo, náhoda bývá blbec.
Dobré zprávy pro GMO děti
Nejvíc kritických hlasů a obav o budoucnost čínských dětí vychází z poznatku amerického vědce Xinzhu Wei, statistika z University of California v Berkeley a Dána Rasmus Nielsena z University of Copenhagen. Ti ve své práci popsali, jak je mutace v genu pro CCR5 pro lidi škodlivá.
Jak se ale ukázalo, závěr dělali ze špatných vstupních dat a jejich práce je tudíž nesmyslem. Článek proto musel být stažen.
Což o to, stát se to může. Zvláštní na tom je, že když před několika měsíci jejich článek vyšel, tak snad nebylo člena etické komise, který by závěry práce nešermoval. I media se předháněla, která prohlášení vidiny brzké smrti čínských dvojčat, přinesou jako první. O tom, že byl článek stažen, se už prakticky nepíše.
Závěr
Dál platí, že škody zákroku by mohly převýšit jeho výhody. Přibývá ale dalších dobrých zpráv. Kromě již zmíněného stažení článku prorokujícího vyhlídky brzké smrti, je tu ještě něco. S virovou infekcí HIV to přitom nijak nesouvisí. U osob nesoucích mutaci v proteinu CCR5 vědci zjistili snadnější regeneraci mozku po mrtvici. Myší mutanti s vyblokovaným genem zase vykazují známky vylepšeného mozku a posílené duševní schopnosti. I když většinový názor odborníků zní: „čínský pokus byl předčasný a nedokonalý“, ať se nám to líbí, nebo ne, děti s upravenými geny pro CCR5 již čáp několika rodičům přinesl. Jediné co teď můžeme, je popřát jim, aby měly štěstí a byly z nich „Superčíňanky“, které kromě vylepšené odolnosti k HIV infekci, získaly i vylepšenou paměť. V každém případě se Lulu i Nana již staly velvyslankyněmi do světa lidí s upraveným genomem.
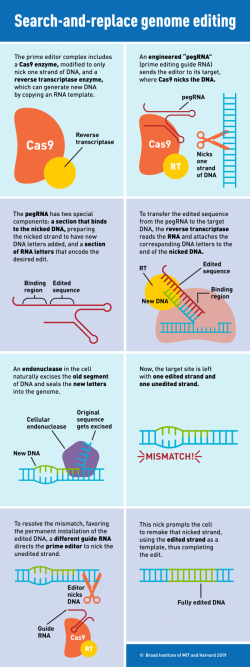
Publikací věnovaných úspěchům techniky „CRISPR“, je doslova příval. Před několika hodinami například tým vědců z MIT a Harvardu oznámil, že spojil CRISPR-Cas9 s reverzní transkriptázou do jediného „stroje“ s potenciálem opravit až 89 procent známých genetických odchylek způsobujících onemocnění. Lze očekávat, že další upravování lidského genomu na sebe nenechá dlouho čekat. Zda se společnosti tento trend podaří nějak rozumně ukočírovat, nebo z těch, co na to budou mít prostředky, vzejde kasta „lepšolidí“, je otázkou.
Poznámka
Dnes publikovaná novinka z dílny Broad Institute (MIT) se od předchozích CRISPR systémů liší v tom, že k přímému vkládání nových sekvencí DNA do lidských buněk používá RNA. Vysoké přesnosti zákroku a minimalizaci nechtěných přepisů se podařilo dosáhnout spojením CRISPR-Cas s reverzní transkriptázou. Systém, který k úpravě genomu použil Jiankui He, má nevýhodu v tom, při editaci vznikají dvojité konce řetězců (dvouřetězcové zlomy) v cílové sekvenci a že k úpravě využívá šablonu DNA dárce.

Nový molekulární komplex používá jen jedno vlákno cílového místa DNA k „aktivaci“ nebo iniciaci a zápisu upravené genetické informace do genomu. Umožňují to služby upravené RNA, nazvané pegRNA. Ta směruje hlavní editor na cílové místo, kde modifikovaný Cas9 stříhá jen jeden z řetězců DNA. PegRNA obsahuje další RNA nukleotidy, které kódují novou upravenou sekvenci. Pro přenos této informace ale využívá ke čtení prvek reverzní RNA transkriptázu. Odpovídající nukleotidy se do cílového místa zapisují na základě čtení prodloužené RNA.
Protože jde o techniku, s níž se budeme setkávat často, tak ještě jednou a trošku jinými slovy:
Cas9 je zfúzován s enzymem reverzní transkriptáza. Ta oplývá schopností zapsat informaci uloženou v RNA do DNA. Rozšířená vodící RNA, označovaná jako prvotní editační průvodce (pegRNA), je konstruována tak, aby nejen specifikovala cílové místo, ale navíc i kódovala požadovanou editaci a primární reverzní transkripci. To zajistí, že se požadované úpravy z pegRNA přenesou do cílového místa. Technologicky jde o vytvoření meziproduktu se dvěma jednořetězcovými DNA vychlípeninami. Neupraveným 5 'koncem vlákna DNA a 3' koncem DNA vlákna s upravenou sekvencí pocházející z pegRNA. Protože 5'- konec je lákavým cílem endogenních endonukleáz (enzymů přítomných v buňkách), bude 3'-editovaný konec řídit vkládání editovaného DNA řetězce (vytvářet heteroduplexní DNA). Opravné zařízení buňky tak samo a trvale nahradí původní sekvenci v řetězci DNA za upravenou.
Výhodou nové metody je možnost jejího širokého uplatnění. Je vhodná jak provádění záměn jednoho písmene, tak výměně celých segmentů DNA, a to až do délky 44 písmen. Případně jí lze vystřihovat (dělat delece) řetězce až do délky 80 nukleotidů. A pochopitelně i různé kombinace těchto oprav a vylepšovacích úprav. Tvůrci metody uvádějí, že mezi geny, které již v lidských buňkách úspěšně novou metodou editovali, patří i geny zodpovědné za onemocnění, jakými je například srpková anemie, nebo Tay Sachsova choroba (Během prvních měsíců normální novorozenci začnou přehnaně reagovat na hlasitější zvuky, po půl roce jim začne degenerovat mozek a během tří let jako slepí a hluší umírají. Na vině je defekt v genu HEXA).
Neméně potěšitelné na počinu objevitelů a jejich institutu je, že většinu z této technologie volně zpřístupňují akademickým a neziskovým komunitám. Vše nasvědčuje tomu, že doba masivní genové léčby je doslova za dveřmi.
Literatura
Xinzhu Wei, Rasmus Nielsen.: CCR5-Δ32 is deleterious in the homozygous state in humans, Nature Medicine (2019). DOI: 10.1038/s41591-019-0459-6 , https://www.nature.com/articles/s41591-019-0459-6 (TENTO ČLÁNEK BYL 8. října 2019 STAŽEN).
Regalado, Antonio.: "China's CRISPR twins might have had their brains inadvertently enhanced - New research suggests that a controversial gene-editing experiment to make children resistant to HIV may also have enhanced their ability to learn and form memories". MIT Technology Review. Retrieved 21 February 2019.
Herfarth H, Pollok-Kopp B, Goke M, Press A, Oppermann M.: Polymorphism of CC chemokine receptors CCR2 and CCR5 in Crohn’s disease. Immunology Letters 2001; 77: 113-117.
Andrew V. Anzalone et al.: Search-and-replace genome editing without double-strand breaks or donor DNA. Nature (2019) DOI: 10,1038 / s41586-019-1711-4

