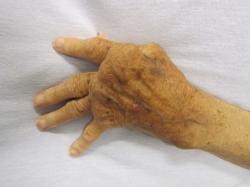
Artritída se často plete s artrózou. Není divu, obě nemoci začínají na „A“ a v obou případech nás bolí klouby. Rozdíl je vtom, že při artróze se jedná o opotřebení chrupavky spojené s námahou a věkem, a příčinou artritídy je porucha funkce imunitního systému. S věkem ani opotřebením chrupavek námahou, to nemá nic společného. Dnešní pojednání o artritídě bude tedy o imunitním systému, jeho buňkách a jakými pokyny se řídí v místě zánětu.
Pomýlený imunitní systém, který si svou zlobu vybíjí na vlastním těle, je poměrně častou záležitostí a v případě artritidy se jedná o celé jedno procento populace. Stávající klasická léčba spočívá v potlačování zánětu nesteroidními antirevmatiky, nebo v krocení agrese imunitních buněk dvousečnými kortikoidy. Ani to ale mnohé z nemocných od jejich pohybové nemohoucnosti neochrání.

Určitou naději nemocným artritídou dává nyní tým americko-skotsko-belgických výzkumníků. Nový přístup k léčbě nemoci popsali v článku v Nature Immunology. Z názvu časopisu určeného imunologům vyplývá, že objev se týká čtení vzkazů, které si buňky píší na svojí povrchovou membránu. A protože své značky si píší a čtou pomocí proteinů, tak se týká i genů zapsaných v DNA, podle nichž si buňky proteiny syntetizují.
Výzkumníci se už dlouho snaží přijít na lepší způsob léčby artritidy, než je ten stávající, který je z hlediska cíleného zásahu přesný asi tak, jak dělostřelectvo za doby Jana Žižky z Trocnova. Populační studie identifikovaly místa v DNA, která činí lidi k nemoci náchylné. Takových lokalit (polymorfismů s jedním nukleotidem „SNP“) je známo několik a nacházejí se v oblastech, které nic nekódují. Příčinnost u nich ale není moc zřejmá a tak ve snaze lépe porozumět faktorům, které k nemoci přispívají, se Američanka Sanja Arandjelovicová věnovala artróze z hlediska buněčné smrti. Společným jmenovatelem postižených kloubů je totiž zánět, při něm buňky houfně mřou. V synoviální kloubní tekutině při artritidě je pak hodně buněk, které si samy ordinují řízenou smrt (apoptózu). Logická představa je, že je potřeba se takových buněk zbavit co nejdříve. Například proto, že tyto "sebevražedkyně" představují riziko i svými ostatky (buněčným detritem). Těmito dobře přístupnými antigeny by totiž mohly provokovat imunitní systém k vyššímu výkonu. Podpořené množení bílých krvinek a jejich šikování do kloubu by zánět jen zhoršovalo. Má se zato, že právě takové „perpetum mobile“ stojí za tím, že se z akutního zánětu ráda vyvine artritida chronická. Pro léčbu tak vzniká dilema - tlumit zánět podporou apoptózy nebo jí raději bránit?
Ke svým pokusům výzkumníci s oblibou využívají hlodavce. Prý se s nimi pracuje lépe než s lidmi a tak díky myší spolupráci dnes už například víme, že buňky se sebevražednými úmysly začnou na svém povrchu vystrkovat značky, které jiným buňkám, těm, které mají v popisu práce velký úklid (fagocytům), signalizují zprávu, která zní: „Sněz mne“. Poříračským fagocytům (neutrofilům a makrofágům) tyto exekuce nepřináší potěšení z jídla, ale je to pro ně náročná činnost. Poté, co jejich čtecí zařízení (receptor) zachytí zmíněný signál, spouští program, kterým pozmění svou membránu. To aby se nově vytvořenými strukturami na svém povrchu byl fagocyt ke své oběti schopen připoutat a mohly nastoupit čety demoličních enzymů. Byť se jedná o likvidaci buněk k tomu svolných, není to ani jednoduché ani energeticky levné. A to jsme ještě zcela pominuli složitosti, jakými si imunitní systém ověřuje, zda se nejedná jen o nějaký šprým a dílo parazita. I to je třeba kontrolovat, neboť tak jako mezi lidmi, i mezi mikroby se najdou filištíni, kteří se snaží z oslabení jiného profitovat. Ale to už je jiná písnička, mimo dnešní program.
Jednu z těch lépe poznaných cytoplazmatických signalizačních drah bílých krvinek si vědci nazvali: ELMO-DOCK-Rac. Funkci jakéhosi relé v ní zastává proteinový komplex ovládající záměnu nukleové báze (guaninu). Když si jeho úlohu zjednodušíme, tak s jeho pomocí fagocyt ovládá své "svaly" (aktinová vlákna) na své buněčné "kostře" (cytoskeletu). Umožňuje mu to nabývat tvarů, které potřebuje, aby buňku nešťastnici, která si o to řekla, mohl „shltnout“. Studiu uvedené dráhy se věnoval tým, jehož myšlenkovým vůdcem je Kodi Ravichandran a největší pracovní zásluhu na výsledku má Sanja Arandjelovic. Výzkumníci měli v úmyslu nejprve lépe porozumět signalizaci mezi buňkami páchajícími apoptózu a jejich odstraňovači. Pak teprve, pokud to poznatky umožní, začít uvažovat o tlumení artritidy. Podařilo se, jen poněkud v jiném pořadí, než měli v plánu.
Pokusy probíhaly na modifikovaných myších. Výzkumníci je připravili o schopnost tvořit protein (ELMO1). Chyběl jim tedy gen pro tvorbu důležitého signalizačního proteinu. Výsledkem byly myši, jejichž „porouchané“ fagocyty (bez antény) nebyly schopny si pořádně číst vzkazy od jiných buněk. Že jim mutace ztížila schopnost odklízet nepořádek sebevražedkyň, je nejspíš zbytečné dodávat. Podle všech předpokladů mělo u takto hendikepovaných stvoření dojít k rychlejšímu nástupu artritídy a rovněž i průběh nemoci měl být horší. Že by k takovému vývoji mělo dojít, nasvědčovaly i poznatky z pokusů u jiných nemocí, u nichž také o uzdravení rozhoduje správně provedený nábor a směrování imunitních buněk k provedení „špinavé práce“ v místě zánětu. Stalo se ale něco nečekaného.
Ztráta signalizačního proteinu myším jejich artritidový úděl ulehčovala. Vědci se tak dobrali něčeho, k čemuž měli v úmyslu dojít až po lepším pochopení procesů vedoucích k artritidě. Že k tomu došlo už teď, je prý nijak netrápí.
Závěr
Protein ELMO1 hraje na povrchu imunitních buněk roli antény která čte vzkazy od buněk, které se rozhodly v zánětlivém ložisku provést apoptózu. Zmíněný protein není jen povrchovou strukturou (anténou), má i svůj druhý konec, který zasahuje do cytoplazmy, kde spouští příslušný sled dějů vedoucích k fagocytóze. Vypnutím genu pro tvorbu tohoto proteinu myším pacientům artritidu nezhoršilo, opak byl pravdou. Překvapení je předzvěstí nových způsobů léčby artritidy i u lidí. Ať už to bude cíleným tlumením genu, nebo protilátkou znefunkčnění jeho produktu (antény). Oběma způsoby by mělo jít ovlivnit proces zvaný chemotaxe a tím i migrace neutrofilů a průběh zánětu. Neméně důležitým poznatkem je, že vyblokování genu pro ELMO1 protein myškám jejich odolnost vůči bakteriální infekci nijak nesnížilo. I proto má nový poznatek šanci brzo najít uplatnění v klinice a vylepšovat kvalitu života milionům pacientů.
Literatura
Sanja Arandjelovic et al.: A noncanonical role for the engulfment gene ELMO1 in neutrophils that promotes inflammatory arthritis, Nature Immunology (2019). DOI: 10.1038/s41590-018-0293-x