K problémům se zapínáním knoflíků se záhy přidá nemotorné otáčení klíčem v zámku. Když je to za střízliva, je to na pováženou a nejspíš jde o signál toho, že náš mozek přestává ovládat svaly. Postupně přestaneme chodit, mluvit a pak i dýchat. Abychom se nezadusili, musejí nás napojit na umělou plicní ventilaci. V samém závěru se s okolím domluvíme už jen mrkáním očí – jednou ne, dvakrát ano. Ve finále už jen otáčíme bulvy. Ať už budeme viníkovi říkat osud, nebo kvůli vadnému sestřihu „krejčí“ či jinak, je od něj nelidské, že při tom všem psychické a mentální schopnosti zachovati ráčí. Pouze jednomu z pěti se dostane to štěstí, že ho současně s ALS sklátí i demence.
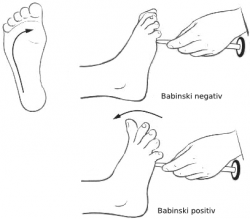
ALS, neboli Amyotrofickou laterální sklerózu, veřejnost zná především zásluhou Stephena Hawkinga. Ti, co se o astrofyziku nezajímají, mají u nás ALS spojenu s dabérem Martinem Kolárem, jehož hlas nás provázel u Worfa ze Star Treku, Chefa ze South Parku či Lockharta z Harryho Potera. Mnozí z lékařů „tradicionalistů“ ale nemocným neříkají, že mají ALS, ale postaru, že trpí Lou Gehrigovou chorobou. Není to na počest jejího objevitele, jak bývá u lékařů zvykem, nýbrž to je z pocty k Lou Gehrigovi. Famóznímu baseballovému kouzelníkovi z New York Yankees, u něhož ALS kdysi diagnostikovali. Nemoc nepostihuje jen slavné a mocné. Podobně jako Babinského reflexem postihla našeho nejmladšího z premiérů, svou daň si ročně vybere zhruba na třech z každých sto tisíc obyvatel. Některé statisticky vypovídají o tom, že nemoc řádí více mezi vojáky a že rizikové povolání je být profesionálním fotbalistou, nicméně nejspíš jde o mystifikaci, za níž mohou častější pečlivé zdravotní prohlídky, které nemoc včas odhalí. S léčbou je to stále více než špatné. Ať už jde o syntetiku methylcobalamin, Edaravone, či transplantaci živých kmenových buněk, úspěchem je, když se postupující progres podaří zpomalit. Vyléčit se zatím nikomu nikoho nepodařilo a to ani za pomoci čínské medicíny, homeopatik, baněk a zaříkávání.
V tomto týdnu v časopisu Cell Reports vyšel článek od party z Harvard Medical School, která se specializuje na ALS a jí občas doprovázející poruchu zvanou FDT (frontotemporální demence). Snažili se najít jejich příčinu. Tady náš článek může končit. Odborníkům k jeho popsání stačí jediná věta: Příčinou ALS i FTD je mutace v C9ORF72 s vlivem na spliceosomální sestřih pre-mRNA.
Ne všichni ale máme doktorát z molekulární genetiky, a tak si to rozvedeme. „Jiný kraj jiný mrav“ a pokud se o problému budete chtít bavit s někým z ciziny, je dobré ve Francii akceptovat jejich odborný termín „maladie de l'emmuré vivant“, jehož doslovný překlad zní „zazdění zaživa“. S Angličany si porozumíte s „locked-in syndrome“, což se dá přeložit jako „syndrom uzamčení“. V Americe neprohloupíte s termínem „Lou Gehrigova choroba. U nás spíš s jmenovanou „ AL-sklerózou“.
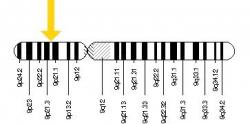
Delší dobu se už tak nějak tuší, že by neblahou roli v tom všem měla hrát degradace proteinů. A nejspíš tomu tak i bude, jak tomu nasvědčuje i nynější publikace, v níž kladou vinu toxickým peptidům. Jejich tvorbu má na svědomí mutace v genu. I on už dostal své jméno. Říkají mu: C9ORF72. A aby se to nepletlo, tak jeho produktu (proteinu) také říkají C9ORF72 (jen se to pak nepíše italikou). V předevčírem zveřejněné studii v časopisu Cell Reports vědci z Harvard Medical School popisují, jak peptidy – dílo onoho zmutovaného genu, dokáží být toxické. Postarají se o vznik zmatků a zmetků při montáži spliceosomu. Tím se rozumí molekulový "stroj“, který nám zajišťuje sestřih RNA v našich buňkách.
A jak že tato mutace svému nositeli postupnou ztrátu nervových buněk s fatálním koncem přivodí? Nenápadně. Nahromaděním mnoha kopií malých úseků v DNA. Spíš než malých na ně sedí slovo titěrných. Tvoří je pouhopouhých šest nukleotidů. Buňky je převádí do podoby messenger RNA-molekul a ty už jsou instrukcemi pro produkci peptidů. Jde o klasický projev celé řady mutací. Je-li pokyn z DNA špatný, nesprávná informace se prostřednictvím ribonukleové kyseliny „přetaví“ do špatných proteinů.
U dvou proteinových dipeptidových molekul (GR a PR) se ukázalo, že v lidských buňkách dělají stejnou neplechu, jako způsobují v buňkách kvasinek. To samé zvládnou i v buňkách mušek octomilek. A tak díky těmto živým modelům už víme, jak své dílo zkázy proteinové molekuly páchají. Zvyšují počet chyb v sestřihu. Co je termínem sestřih míněno? Genetici tak označují proces, kterým si buňky upravují surovou messenger RNA. Ta totiž zpočátku po svém vzniku obsahuje nadbytečné segmenty a ty je třeba nejprve vystřihnout a zahodit. Teprve po krácení molekuly v těch správných místech je „zeštíhlená“ RNA zralá plnit svou funkci – a stát se čitelným plánem a návodem výroby (sestavování) proteinu.
Jinak řečeno, Angličané zjistili, že přítomnost nicotných GR a PR peptidů náš molekulární stroj, mající v popisu práce sestřih ribonukleové kyseliny, zadrhne asi tak, jako když si motor nasaje písek. V cytoplazmě se následně začnou hromadit zmetky, které vědci nazvali podobně poeticky: U2 snRNP. Za normálních okolností to je malá molekula ribonukleové kyseliny, která má své místo v jádře buňky, kde je jedním ze soukolí stříhacího procesu.

Nás spíš v souvislosti s nemocí zajímá, jak mutační chybou vyprodukované jedovaté proteiny svou destrukční práci provádí v buňkách, mezi něž bohužel patří i motorické neurony. Ty potřebujeme k ovládání našich svalů. V praxi to znamená, že se nám mutací pomatený "krejčí“ lajdáckým stříháním ribonukleové kyseliny postará o pokles energie produkované malými elektrárnami – mitochondriemi. Buňky začnou energeticky hladovět. Tuto odbočku k mitochondriím zde zmiňujeme záměrně. Invalidní mitochondrie se totiž již dříve jiným týmům pozdávaly být příčinou ALS. Nejde ale jen o to, že šlendriánský sestřih pokynů má za následek hendikepované mitochondrie. Mutace se vyřádí i ničením pokynů pro růst a výstavbu struktury neuronů.

Pokud jste se dostali k originálnímu článku, anebo z tohoto našeho pojednání nabyli dojmu, že nám genetické laboratoře, které vyrostly jak houby po dešti, až už je jich tolik, že se o nás přetahují, aby nám určily odkud pocházíme, zda jsme skutečnými otci, nebo nám předpovídají, co nás čeká, teď z výtěru v puse také vyčtou, zda nám hrozí "zazdění za živa", pak je to špatně. Jednoduše proto, že ne všechny ALS lze strčit do stejného pytle. Jsou i takové, pro něž se začíná razit termín sporadické. Ty žádnou známou genetickou příčinu (vadný gen) nemají. A co je nejhorší, těch je 90 % :(
Závěr
Pro naprostou většinu nemocných ALS nový poznatek nejspíš žádný význam nemá. Nicméně pro deset procent postižených jistou nadějí možné budoucí léčby je. Zajímavé na tom je, že by léčba neměla probíhat tak, jak se nám všem vybaví, protože se o tom hodně mluví – opravou vrozené vady v genomu, tedy záplatováním nukleotidů ve vlákně chromozomu. V představě vědců je něco jiného. Hodlají buňkám dopřát lektvar, jemuž dali jméno - „modulátor sestřihu“. Ten, který by byl vhodný pro tuto příležitost, ještě nemají, ale už po něm začali pátrat.
Literatura
S, Lopez-Gonzalez R, Kunz RC, Gangopadhyay J, Borufka C, Gygi SP, Gao F-B, Reed R (2017) Evidence that C9ORF72 dipeptide repeat proteins associate with U2 snRNP to cause mis-splicing in ALS/FTD patients. Cell Reports 19: 2244-2256
Harvard Medical School – Reed Lab. News
DeJesus-Hernandez M, et al.: "Expanded GGGGCC hexanucleotide repeat in noncoding region of C9ORF72 causes chromosome 9p-linked FTD and ALS". Neuron. 72, 2011. doi:10.1016/j.neuron.2011.09.011.Renton AE, et al.: "A hexanucleotide repeat expansion in C9ORF72 is the cause of chromosome 9p21-linked ALS-FTD". Neuron. 72, 2011. doi:10.1016/j.neuron.2011.09.010
Diskuze: