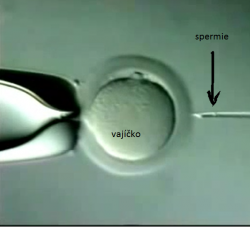
V současné době využívá evropská populace tzv. asistované reprodukce velmi intenzivně; téměř 8 % párů totiž vyhledává pomoc klinik asistované reprodukce. V České republice je to nepatrně méně, ale i tak se zde ročně provede na 25 tisíc in vitro oplození, chceme-li nepřesně „oplození ve zkumavce“. Příčinou takového pohlídaného oplození je neplodnost, která je definovaná půlročním snažením párů o početí přirozenou cestou a bez úspěchu. Z pohledu neplodnosti si muži ani ženy nemají co vyčítat – lékaři se potýkají jak s anatomickými malformacemi ženského genitálu, tak s nízkou kvantitou i kvalitou spermií. Důkazem budiž neustále se změkčující se normy Světové zdravotnické organizace (WHO) pro mužský ejakulát. Pokud by ke „snižování laťky“ nedocházelo, centra by měla tak málo dárců spermatu, že by mohla zavřít a Evropa by vyhynula po meči. To ovšem neznamená, že měkčí normy vyléčili mužskou neplodnost! Na pomoc přichází zlepšováky asistované reprodukce; jeden z mocných nástrojů je injekce spermie přímo do vajíčka (ICSI, intracytoplasmic sperm injection). Metoda ICSI se dnes využívá naprosto rutinně, protože spermie se ne a ne hýbat tak, aby do vajíčka vlezly samy a bez pomoci.
Jednou z indikací k použití ICSI jsou anatomické anomálie spermií, díky kterým spermie není schopná adekvátního pohybu a schopnosti proniknutí do vajíčka. Za pohyb spermie je totiž odpovědný cytoskelet bičíku spermie, přesněji proteiny tubulin, aktin, dynein a celá řada dalších. Jako jakékoliv jiné proteiny, také tyto jsou zapsané v genetické výbavě každého z nás. Pokud dojde k mutaci v genu pro dynein, nemusí to u žen zákonitě znamenat tragédii. U mužů to ovšem může vyvolat defekty spermií, kdy jsou bičíky pokroucené a spermie oplození neschopné. Tento genetický defekt lze u dárců spermatu diagnostikovat a vliv takového defektu sledovat, sice na úspěšnosti oplození vajíček jejich spermiemi.
Zatímco nikdo nepochyboval o handicapu takových spermií v momentě oplození, nikdo stejně tak nepředpokládal, že by taková spermie mohla nést další defekty v chromatinu spermie, odpovědné např. za Downův syndrom. Až reprodukční biologové z Univerzity v Grenoble nejen že ve své studii neprokázali kdovíjak převratnou predispozici takových spermií ke genetickým přešlapům, ale navíc poukázali na fenomén, který je přinejmenším zaskočil: defektní spermie totiž byly v oplození vajíček metodou ICSI ještě úspěšnější než spermie zdravé!
Protože nic není černobílé, také výsledky zmiňované reprodukční studie lze interpretovat s různou mírou odvahy. Spermie s defektním bičíkem totiž nevykazují genetické defekty na 21. chromozómu, jehož trizomie způsobuje obávaný Downův syndrom. Nicméně, spermie mužů s genetickou mutací jsou častěji obtěžkány 18. chromozómem navíc, což je příčinou stejně nežádoucího Edwardsova syndromu. Na této „nevýhodě“ nic nezmění skutečnost, že Edwardsův syndrom se v lidské populaci vyskytuje výrazně méně, protože je často eliminován vyšší embryonální úmrtností…
Na druhou stranu, výhoda postižených spermií v metodě ICSI je vyjádřena počtem oplozených vajíček, kdy úspěšnost oplození roste o téměř 7 %, a to v humánní reprodukci není málo! Ovšem to ještě neznamená, že z oplozených vajíček se vyvine kvalitní embryo schopné přenosu do těla matky. V ukazatelích, jako je schopnost implantace embrya nebo skutečná klinická gravidita, jsou tyto spermie srovnatelné se ‚zdravou‘ kontrolou; není ale jen toto vcelku příznivé? Očekávali bychom negativní efekt v těchto ukazatelích, a ten nikde…
I přes rezervy, kterými je studie ověnčena, nabízí práce francouzských vědců nemalé možnosti. Období embryonálního vývoje mezi samotným oplozením a implantací takto vzniklého embrya je dosud neúplně prostudováno a nabízí tak spoustu možností, jak embryu ve vývoji pomoct. Až se toto povede, možná že odhalíme skutečný potenciál ‚postižených‘ spermií. Vždy ale s ohledem na vysvětlení tohoto absurdního jevu, abychom na prosté empirii nezadělali na ještě větší průšvih. Až budeme schopní dát embryu v podmínkách in vitro to nejlepší, včetně kvalitní spermie vstupující do klíčového momentu oplození vajíčka, bude výroba dětí „ze zkumavky“ zase o krok dále.
Video: ICSI
Asistovaná reprodukce (ART, assisted reproductive technologies) je kontrolovaný proces oplození vajíčka spermií. Avšak nejen to – oplození předchází odběr pohlavních buněk, spermie (přesněji ejakulát) masturbací a vajíčka transvaginální aspirací. Po oplození následuje kultivace embryí, která oplozením vajíček vzniknou. To vše se odehrává v podmínkách in vitro, v překladu „ve skle“. Dnes je už laboratorní sklo nahrazeno jednorázovým laboratorním plastem, pojmy ale zůstávají beze změny. V asistované reprodukci se ale můžeme setkat také s dalšími obraty:
Transvaginální aspirace představuje vcelku náročný zásah do těla matky, kdy pod kontrolou sonografu dochází punkcí přes stěnu pochvy (vaginy) k odběru vajíček. Vaječník a na něm vzniklé měchýřky – folikuly, obsahuje zralá vajíčka, která se „vycucnou“ a dále připravují na oplození mimo tělo matky, v podmínkách in vitro. Aby byl celý zásah korunován dostatečným počtem odebraných vajíček a poté kvalitních embryí, je dárkyně/matka mnohdy hormonálně stimulována, aby na vaječníku bylo folikulů s vajíčky více.
In vitro oplození (IVF) v tom tradičním slova smyslu znamená „koktejl“ vajíček matky a spermií tatínka v Petriho misce, ze které se po několika hodinách vyjmou oplozená vajíčka. Poté následuje další kultivace oplozených vajíček, ze kterých vznikají embrya. Embryonální vývoj se potýká s různou úspěšností a ne vždy je zakončený kvalitním embryem, které lze přenést zpět do těla matky. Na vině jsou často spermie, které ani neproniknou do vajíčka a tak vůbec nedojde k jeho oplození.
Intracytoplazmatická injekce spermií (ICSI) představuje sofistikovaný nástroj, který výrazně zvyšuje úspěšnost embryonálního vývoje. Tato metoda totiž eliminuje riziko, kdy spermie do vajíčka neproniknou, a proto se v dnešní době používá rutinně. Na druhou stranu, ICSI představuje poměrně razantní zákrok, který má k fyziologickému oplození daleko. Embryolog sice vybírá spermie, které jsou bez viditelných defektů a s adekvátním pohybem, nelze se však vyhnout jisté nepřesnosti, která výběr spermie doprovází. Nehledě na genetické poruchy, které neschopnost spermií proniknout do vajíčka způsobují a pomocí ICSI se předávají do další generace.
Intracytoplazmatická injekce předvybraných spermií (PICSI) je nadstavba ICSI, kdy dochází k selekci spermií na základě jejich enzymatické výbavy. Protože je v přirozeném prostředí mnoho bariér, které spermie musí zdolat, k vajíčku se dostane jen hrstka nejschopnějších. V in vitro podmínkách je tento výběr simulován právě pomocí PICSI. Jen spermie, které se naváží na gel z hyaluronové kyseliny, jsou vybrané pro ICSI. Hyaluronová kyselina v tomto případě představuje náhražku za obal tzv. kumulárních buněk, které nejen že obklopují ovulované vajíčko, ale tvoří velké množství hyaluronové kyseliny. Ta slouží jako jedna z bariér pro spermie, které ji musí enzymaticky „rozpustit“. Lze očekávat, že pokud spermie postrádá enzymatické aparát pro průnik hyaluronovou kyselinou, budou jí chybět i další komponenty pro oplození a časný embryonální vývoj.
Preimplantační genetická diagnostika (PGD) představuje velmi užitečný nástroj pro eliminaci rizik narození postiženého dítěte. Na vině může být přítomnost některých chromozómů ve trojím (a nikoliv dvojím, diploidním) vyhotovení. V takovém případě se jedná o tzv. trizómii, přesněji 21. chromozómu (způsobující Downův syndrom), 18. chromozómu (Edwardsův syndrom) nebo trizómii 13. chromozómu (Patauův syndrom). Příčina začíná opět u pohlavních buněk, spermií nebo vajíček, ve kterých je jeden z těchto chromozómů v diploidní sestavě. Pokud se k němu přidá další chromozóm ze zdravé pohlavní buňky, vznikají v embryu nežádoucí trizómie. Mimo trizómií se může jednat o další genetické poruchy vázané na pohlaví, jedna z nejznámějších je odpovědná za hemofílii. To lze v in vitro podmínkách velmi spolehlivě odhalit, sice na jediné buňce, která se z již několika-buněčného embrya vyjme. Pokud se genetický defekt prokáže, embryo se do těla matky vůbec nepřenese.
Ačkoliv je incidence zmíněných poruch v populaci vcelku nízká (desetiny až setiny procenta), může u některých párů výrazně stoupnout riziko početí takto postiženého potomka. Důvod je často velmi pragmatický, totiž věk. Proto je PGD u žen po 40. roku věku prováděna standardně a je hrazena zdravotní pojišťovnou. I přes užitečnost zákroku představuje vyjmutí buňky z embrya invazivní zásah a tak se k němu přistupuje jen v případě hrozícího rizika.
Embryotransfer je velkým finále asistované reprodukce. In vitro techniky nejsou a nikdy nebudou schopny nahradit dělohu matky, kde dochází k uhnízdění embrya - nidaci. Embryo kultivované in vitro je tak nejčastěji po 5 dnech připraveno pro transfer do těla matky. Když je úspěšnost in vitro oplození a embryonálního vývoje vysoká, „nadbytečná“ embrya se zamrazí v tekutém dusíku při -196°C. Takové „mrazíky“ lze přenést i o několik let později stejné matce, která se rozhodne pro další dítě. Příjemná je na tom skutečnost, že matka už nemusí podstupovat nepříjemnou transvaginální aspiraci vajíček.
Zdroj
Wambergue, Clémentine, et al.: Patients with multiple morphological abnormalities of the sperm flagella due to DNAH1 mutations have a good prognosis following intracytoplasmic sperm injection. Human Reproduction (2016): dew083.
Diskuze: