Antibiotiká fungujú tak, že narušujú metabolizmus mikroorganizmov. Nejde o fyzickú likvidáciu, skôr o záludnú otravu metabolicky aktívnych, množiacich sa jedincov. V populácii mikróbov sa vyskytuje aj množstvo metabolicky málo aktívnych, nedeliacich sa "driemajúcich" buniek - persisterov, ktoré dokážu tolerovať účinok bežných antibiotík. (poznámka - jedná sa tu o toleranciu antibiotík, nie o rezistenciu - tolerancia sa na rozdiel od rezistencie nededí). Perzistujúce mikróby sa ukrývajú v povlaku - biofilme napríklad na povrchu umelých materiálov - katétrov, protéz, unikajú účinku antibiotík a sú príčinou opätovného vzplanutia infekcii.
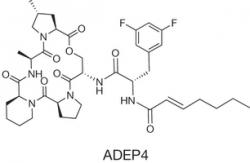
Na perzisterov zo skupiny grampozitívnych baktérii však účinkuje nová trieda antibiotík - acyldepsipeptidy (ADEP). Tieto ireverzibilne aktivujú proteín ClpP - podjednotku enzýmu zo skupiny proteáz, ktorý sa podieľa na regulovanej degradácii špecifických proteínov. Fígeľ spočíva v tom, že v prítomnosti ADEP proteolýza sprostredkovaná ClpP nie je závislá na dodávke energie v podobe adenozíntrifosfátu (tým ani na aktivite metabolizmu mikrobiálnej bunky). Výskumníci si to všimli a vyskúšali účinok acyldepsipeptidu ADEP 4 na stafylokoky.
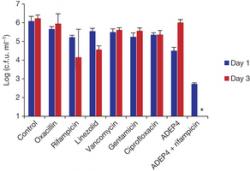
V prvých experimentoch vystavili účinku acyldepsipeptidového antibiotika ADEP 4 driemajúce baktérie Staphylococcus aureus. To sú veľmi nebezpečné mikroorganizmy, ktoré si vypestovali rezistenciu proti väčšine známych antibiotík. Prežívajú v nemocničnom prostredí a spôsobujú okrem iného aj ťažko liečiteľné infekcie operovaných pacientov. V experimente došlo k degradácii viacerých baktériových proteínov v mnohých metabolických dráhach. Počet bakteriálnych buniek sa znížil o niekoľko rádov, ale prežili bunky s deficitom ClpP.
Kredit: Nature
Rast selektovanej populácie s deficitom ClpP je zlou správou, ale je tu aj lepšia: kombinácia ADEP 4 s bežnými antibiotikami ciprofloxacinom, linezolidom alebo rifampicinom bola synergisticky baktericídna nielen in vitro ("v skúmavke"), ale aj u pokusných myší s chronickou infekciou Stafylococcus aureus v biofilme, ktorá predtým nereagovala na liečbu rifampicinom a vankomycinom (vankomycin pritom patrí medzi veľmi účinné, ale toxické antibiotiká, používané ako jedna z posledných možností). Kombinovaná liečba ADEP 4 a rifampicinom však dramaticky znížila počet mikróbov až pod hranicu detekovateľnosti.
Rýchly nástup ClpP deficientných mutantov po vystavení acyldepsipeptidu hneď na počiatku poukazuje na potenciálne obmedzenie tejto novej skupiny antibiotík. Ďalším obmedzením je, že príliš veľká molekula ADEP nepreniká cez membrány gramnegatívnych baktérii, medzi ktoré patrí napríklad problémová Pseudomonas aeruginosa. Ale tento výskum ukázal, že antibiotiká zacielené na metabolické dráhy driemajúcich mikroorganizmov sa môžu stať užitočným nástrojom na liečbu chronických infekcii, z ktorých veľkú časť spôsobujú práve driemajúce baktérie v biofilme.
Zdroj: B.P. Conlon et al., “Activated ClpP kills persisters and eradicates a chronic biofilm infection,” Nature, doi:10.1038/nature12790, 2013 a komentáre ZDE.
Analog herbicidu účinným antibiotikem
Autor: Václav Diopan (25.04.2019)
Opäť nádejné nové antibiotikum
Autor: Matej Čiernik (05.02.2015)
Diskuze:
Antibiotika nejsou jediný způsob..
Marian Varga,2014-01-06 01:08:17
"Roky sa píše o tom, že onedlho nebude čím liečiť infekčné choroby. Na staré antibiotiká postupne vzniká rezistencia a nové sa príliš intenzívne nevyvíjajú."
Antibiotika naštěstí nejsou jediným způsobem léčby bakteriálních infekcí. Zabývám se výzkumem meticilin-rezistentních kmenů bakterie Staphylococcus aureus, které patří mezi nejzávažnější patogeny a jejich rozsáhlá rezistence k antibiotickému arzenálu působí hodně velký celosvětový problém. Jak je známo, tyto malé příšery již překonaly každé dostupné antibiotikum - penicilin (pozdní 40. léta), meticilin (1961) a také nejefektivnější protistafylokokové antibiotika linezolid (2000), vankomycin (2002) a daptomycin (2003). Docela katastrofa.
Může se zdát, že se řítíme do před-antibiotické éry, protože s některými kmeny S. aureus (ale i dalšími druhy bakterií) se dá jen hodně těžko bojovat. Je tady však jeden zásadní rozdíl - v současnosti (na rozdíl od skutečné před-antibiotické éry) máme znalosti a metody jak se vypořádat s nebezpečnými bakteriálními infekcemi jinými způsoby než antibiotiky. Proto si myslím, že bychom neměli moc lpět na těchto chemikáliích a raději se snažit zlepšit nejnadějnější alternativy.
Jednou z nich je fágová terapie, která je založena na využití bakteriofágů (virů bakterií) k zneškodnění nebezpečných bakterií. Oproti antibiotikům má fágová terapie některé velké výhody, např.: 1) bakterie si vůči fágům (často používaný zkrácený tvar slova) nedokáží vytvořit rezistenci v dlouhodobém horizontu, protože fágy také podléhají mutacím a některé z těchto mutací pomohou překonat bakteriální rezistenci => nikdy nekončící závod (pozn. – můj názor je takový, že je malinko hloupé, resp. naivní snažit se bojovat proti bakteriím s něčím se stabilní a neměnnou strukturou jako jsou antibiotika); 2) fágy jsou vysoce specifické, konkrétní bakteriofág je schopen infikovat pouze určitou skupinu kmenů bakterií => chrání mikroflóru organismu; 3) fágové preparáty mají nesrovnatelně vyšší účinnost než antibiotika, např. u druhu Staphylococcus aureus se účinnost fágových preparátů pohybuje mezi 90-100 %, zatímco účinnost antibiotik je mnohem nižší => efektivní léčba; 4) produkce fágových preparátů je mnoho- mnoho- mnohokrát levnější než produkce antibiotik => levnější léčivo; 5) produkce fágových preparátů je taktéž mnohem rychlejší než produkce antibiotik => bez komentáře.. V současnosti již jsou k dispozici fágové preparáty pro léčbu infekcí způsobených bakteriálními rody Staphylococcus spp., Pseudomonas spp., Streptococcus spp. atd.
Je tady však několik problémů, které brání zavedení fágové terapie do praxe. Ze všeho nejvíc je to farmaceutický průmysl, který bude radši prodávat drahá a „napůl funkční“ antibiotika, na kterých se pořádně nabalí než nesrovnatelně levnější přípravky na bázi bakteriofágů, která jsou navíc účinná, takže není očekáváno jejich dlouhodobější užívání (rozumějte dlouhodobější a opakované nakupování). Dalším problémem je neznalost lékařů, kteří jsou často se znalostmi i jen základů molekulární biologie a nových metod založených na poznatcích tohoto oboru „sto let za opicemi“ (výjimkám se omlouvám a patří jim všechna čest, žel, ta první skupina je počtem několikanásobně převyšuje). Také je u nich cítit určitá neochota v zavádění nových přístupů, takže běžný lékař spíš pacientovi naordinuje některé z používaných antibiotik nejlépe už mezi dveřmi než aby s ním probral další, často efektivnější možnosti (o kterých ovšem mnohokrát ani neví). Jedním z velkých problémů je také strach laické veřejnosti, která už jen při zmínce o terapii založené na bázi virů tuto metodu raději rychle zavrhne. Fágy přitom pro člověka nepředstavují vůbec žádné riziko – tyto viry dovedou napadat a ničit pouze bakteriální buňky, ty lidské jim nechutnají (bakterie rozpoznávají podle specifických receptorů na povrchu jejich buněk – lidské buňky mají úplně jinou povrchovou strukturu, která fágům nic neříká).
Ná závěr bych napsal, že je mi opravdu špatně z dnešní doby, kdy jsou často peníze stavěny nad hodnotu lidského zdraví a nevyužívají se naplno přístupy, které mají potenciál toto zdraví chránit, a to jen proto, že se určitým vlivným skupinám lidí „nehodí do krámu“. Jako vědecký pracovník zabývající se výzkumem bakteriofágů (základní výzkum, žádná peníze-generující společnost) vhodných pro fágovou terapii stafylokokových infekcí mohu konstatovat, že fágová terapie je velmi efektivní možnost, jak nebezpečné bakterie zase dostat pod kontrolu. Byla popsána spousta případů, kdy lidé přežili hrozivé bakteriální infekce po tom, co konvenční medicínské přístupy ztroskotaly a tito lidé byli prakticky odepsáni, jen díky tomu, že podstoupili léčbu pomocí bakteriofágů. Tak proč zatím není tato metoda zavedena do praxe? Bakterie jasně ukázaly, čeho jsou schopny. Teď je zas řada na nás..
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce