Cukrovka (diabetes mellitus), choroba so zvýšenou hladinou glukózy v krvi, je dnes jednou z najrozšírenejších chorôb v civilizovaných krajinách. Objav, izolácia a zvládnutie výroby inzulínu v dvadsiatych rokoch minulého storočia urobili z chronickej smrteľnej choroby liečiteľné, ale celoživotné ochorenie, ktoré pacientov síce väčšinou neusmrcuje samo, ale mnohorakými komplikáciami strpčuje a skracuje ich život. Vývoj týchto komplikácii do značnej miery závisí na tom, nakoľko sa liečbou darí udržovať hladinu glukózy v krvi na hodnotách, blízkych norme.

Glukóza je významný energetický substrát pre bunky nielen ľudského organizmu, bez ktorého niektoré orgány vôbec nedokážu pracovať. Najdôležitejší je mozog - pri znížení hladiny glukózy v krvi pod normálne hodnoty človek upadne do bezvedomia a ak takýto stav pretrváva dlhšie, umiera. Ani vysoká hladina glukózy v krvi však nerobí dobrotu - glukóza je vysoko osmoticky aktívna, čím spôsobuje zvýšené vylučovanie moča obličkami, dehydratáciu a nakoniec smrť. Dlhodobé mierne zvýšenie hladiny glukózy v krvi je jednou z príčin postupného poškodzovania orgánov, vrátane aterosklerózy a po rokoch až desaťročiach trvania nakoniec prispieva k predčasnej smrti chorého.
Reguláciu hladiny glukózy v krvi (odborne: glykémie) riadia špecializované A- bunky a B- bunky pankreasu (t.j. slinivky brušnej - české a slovenské pomenovanie zrejme vychádza z toho, že väčšina tkanív pankreasu vylučuje tráviace enzýmy, odvádzané do dvanástorníka). A- bunky (označované aj alfa- bunky) vylučujú hormón glukagón, ktorý hladinu glukózy v krvi zvyšuje, B- bunky (beta- bunky) tvoria hormóny inzulín a amylín, ktoré hladinu glukózy rôznymi mechanizmami znižujú. Pre vznik cukrovky je podstatný nedostatok inzulínu. Dochádza k nemu dvoma mechanizmami: Po zničení B- buniek v dôsledku infekčného alebo autoimunitného ochorenia vzniká diabetes mellitus 1. typu, ktorý je charakterizovaný veľkým kolísaním hladiny glukózy v krvi a často obtiažnym nastavením liečby. V liečbe je použiteľný len inzulín. Vzniká prevažne u detí a mladých ľudí. Diabetes mellitus 2. typu vzniká v dôsledku vysokej spotreby inzulínu, ktorú už B- bunky nedokážu pokryť, typicky u dospelých obéznych ľudí. V liečbe tohto typu je možné použiť aj iné lieky, ktoré do istej miery znižujú hladinu glukózy v krvi a niektoré z nich možno podávať vo forme tabletiek.
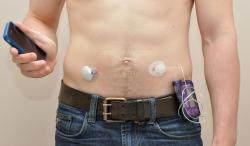
Problémom je najmä liečba cukrovky 1. typu. Kým pri 2. type sa ešte organizmus podiela na regulácii hladiny cukru vďaka zachovanej produkcii inzulínu, pri diabete 1. typu je regulácia úplne v rukách lekára a pacienta. Vylučovanie inzulínu sa zvyšuje po každom jedle a aby sa tento režim napodobnil, inzulín treba podávať vo forme podkožných injekcii viackrát, najmenej štyrikrát denne. (Inzulín je zložitý polypeptid, takže v tráviacom trakte sa beznádejne rozkladá a pokusy s inhaláciou stroskotali na príliš nespoľahlivom vstrebávaní zo slizníc). Niekedy až neriešiteľný problém je nastaviť správne dávkovanie: spotreba inzulínu sa stále mení v závislosti od stravy, vykonávanej fyzickej práce, pridružených chorôb. Presné dávky inzulínu je možné odhadnúť len na základe opakovaného merania hladiny cukru, donedávna len v kvapke krvi, ktorá sa nezískava ináč, len odberom po vpichu do prsta. Desať pichnutí denne (4 podania inzulínu a 6 odberov vzoriek) nie je pre cukrovkára 1. typu ničím výnimočným, a tak to beží po celý zvyšok života. Odhady množstva inzulínu si vyžadujú tiež určité vedomosti a intelekt, takže zďaleka nie každý si dokáže odhadnúť správne dávky. Výsledkom sú kolísavé hladiny glukózy v krvi, straty vedomia z jej občasného nedostatku (hypoglykemické komy) a vývoj komplikácii: poškodenie zraku, zlyhávanie obličiek, poškodenie nervového systému a ďalšie.
Ako zbaviť cukrovkára tohto utrpenia a súčasne priblížiť hladiny glukózy v krvi normálnym hodnotám? Jednou možnosťou je transplantácia celého pankreasu. Operácia je zložitá a doživotná imunosupresia s množstvom hroziacich komplikácii nevyhnutná. Schodnejšia je implantácia samotných B-buniek a pracuje sa na tom, aby mohli byť chránené pred protilátkami príjemcu špeciálnymi biokompatibilnými kapsulami. Génová terapia, prípadne liečba hormónom betatrofínom sú ešte ďalekou budúcnosťou. Betatrofín, u človeka len nedávno identifikovaný hormón, ktorý stimuluje množenie B- buniek, však zrejme príliš nepomôže pacientom s diabetom 1. typu, pretože neodstraňuje hlavnú príčinu ich nedostatku - deštrukciu protilátkami pacienta. Najsľubnejším spôsobom liečby je v súčasnosti zariadenie, ktoré sa trochu nepresne nazýva umelý pankreas (nepresne, pretože nahrádza len endokrinnú funkciu pankreasu, vylučovania tráviacich enzýmov sa netýka).
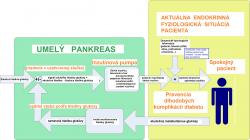
Na tomto zariadení sa pracuje vyše tridsať rokov. Jeho základné časti sú stále rovnaké: senzor, snímajúci hladinu glukózy v krvi alebo v tkanivách, počítač alebo procesor, ktorý vyhodnotí údaje a stanoví potrebnú dávku inzulínu a pumpa, ktorá dokáže dodávať roztok inzulínu vypočítanou rýchlosťou. Ako vždy, všetko je nakoniec zložitejšie, ako by sa zdalo.
Najmenej problémovou časťou je samotná inzulínová pumpa, ktorá sa bežne používa viac, ako dvadsať rokov. Podáva inzulín kanylou, zavedenou pacientovi do podkožia, v nízkej trvalej dávke (bazálnej), ktorá je doplňovaná o rýchlo podané vyššie dávky pred jedlom (bolusy). Tieto dávky si nastavuje a spúšťa pacient na základe merania hladiny glukózy v kvapke krvi, na základe odhadu výdatnosti očakávaného jedla a očakávanej telesnej námahy. (Takto fungujúce inzulínové pumpy označujú vývojári umelého pankreasu ako zariadenia s otvorenou spätnovazobnou slučkou, na rozdiel od umelého pankreasu, ktorý funguje ako zariadenie s uzatvorenou spätnoväzobnou slučkou.) Princíp tejto liečby sa za desaťročia nezmenil, zvýšil sa len komfort ovládania a zmenšila veľkosť zariadenia. Používanie inzulínových púmp prinieslo nejaké skúsenosti pre budúce umelé pankreasy. Poskytli napríklad údaje pre vývoj algoritmov pre riadiaci procesor a viedli k vývoju špeciálnych krátkoúčinkujúcich inzulínov, ktoré nepolymerizujú v zásobníku a kanyle.
Väčším problémom sa ukázalo meranie hladiny glukózy v krvi. Špecifická elektróda je síce k dispozícii už dávno, problémom sa však ukázala biokompatibilita a trvácnosť senzora. Požadovaná presnosť nie je síce extrémna, ale aj tak sú stále nejaké problémy s kalibráciou. Je tu aj otázka, či treba merať priamo v krvnom obehu, alebo stačí meranie senzorom v podkoží - tu sa hladina oproti krvi o niečo oneskoruje, čo kladie vyššie nároky na riadiaci algoritmus (ale prípadná výmena senzora v podkoží je jednoduchšia).
Na riadiaci software pumpy sú kladené vyššie nároky, ako na ľudský organizmus. Pracuje totiž s menej kvalitnými vstupnými informáciami, ale kvalita výstupných signálov je životne dôležitá. V prvom rade, nemá informácie o tom, kedy sa pacient rozhodol najesť. V ľudskom organizme prichádzajú signály hneď, ako sa jedlo ocitne v tráviacom trakte, dokonca ešte predtým - na základe zmyslových vnemov. Umelý pankreas sa dozvie až o zvyšovaní hladiny glukózy v krvi, keď dochádza k tráveniu a vstrebávaniu potravy, pritom však nemá informáciu o jej množstve. Nakoľko aj špeciálny inzulín pôsobí rádovo desiatky minút až hodiny, je ťažké zabrániť poddávkovaniu alebo predávkovaniu inzulínu. Predávkovanie inzulínu môže viesť až k bezvedomiu pacienta a tým až k ohrozeniu jeho života. Pri opakovanom poddávkovávaní inzulínu sú dlhé obdobia s vysokou hladinou glukózy v krvi a tým pádom sa neplní cieľ liečby umelým pankreasom, ktorým je čo najtesnejšie a najdlhodobejšie priblíženie k normálnym hodnotám. Hľadanie riešenia nakoniec viedlo k zostrojeniu dvojitých púmp, ktoré okrem inzulínu podávajú aj ďalší hormón, ktorý umožňuje rýchlejšie reakcie na vzniknutú situáciu. Používa sa buď glukagón alebo amylín. Pacient síce má možnosť informovať svoj umelý pankreas o očakávanom príjme potravy alebo telesnej námahe, ale zariadenie musí vedieť samostatne si poradiť aj s úplne nečakanými situáciami. Výsledné algoritmy sú výsledkom dlhoročnej práce a množstva pokusov na dobrovoľníkoch, vykonávaných za prísnej kontroly v priestoroch kliník. V princípe sa používajú dva druhy algoritmov: klasické spätnoväzobné riadenie v proporcionálno- integrálno -derivatívnom ovládači (PID), alebo modelovo prediktívne riadenie (MPC). Reálne algoritmy využívajú prvky z oboch základných typov, prípadne je doplnená možnosť dodania externých informácii (napríklad o príjme potravy) - ePID. Dôležitým prvkom je modul, zabezpečujúci predchádzanie hypoglykémii - teda príliš nízkej hladine cukru v krvi.
Vývoju umelého pankreasu sa venuje niekoľko skupín a spolupracujú s niekoľkými výrobcami potrebných zariadení - od senzorov a púmp až po ovládače (ktoré sa z notebookov presúvajú do menších zariadení - viaceré sú vybudované na modifikovaných smartfónoch s bežným OS Android). Výsledných riešení je viacero - či sa to už týka použitia výlučne inzulínu alebo aj ďalšieho hormónu, snímania hladiny glukózy v krvnom obehu alebo podkoží, použitých algoritmov. Experimentálne zariadenia boli testované s väčším alebo menším úspechom už vyše 10 rokov. Konkurencia medzi pracoviskami a hlavne medzi výrobcami určite je, no vzhľadom na rozsiahlosť problému prebieha aj intenzívna spolupráca. V roku 2006 vznikla v USA iniciatíva JDRF - Juvenile Diabetes Research Foundation, ktorá v súčasnosti spolupracuje s výskumnými pracoviskami na celom svete.
V súčasnosti má viacero typov externého umelého pankreasu za sebou úspešné testy na ľuďoch v kontrolovaných priestoroch nemocníc alebo detských táborov. Ukázali, že zariadenia sú schopné lepšie regulovať hladinu glukózy a lepšie sa vyhnúť nebezpečne nízkym hodnotám, ako doterajšie metódy liečby. V súčasnosti prebiehajú prvé štúdie, v ktorej sa testuje umelý pankreas v bežnom živote a pre niekoľko ďalších prebieha nábor pacientov. Je predpoklad, že zariadenia budú k dispozícii pre bežné použitie už v roku 2014.
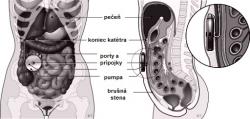
Už dlho sa pracuje na vývoji súčastí implantovateľného umelého pankreasu. Hoci prebieha už predklinické testovanie takéhoto zariadenia na pacientoch a toto dokonca používa sériovo vyrábané komponenty - pumpu a senzor, bežné použitie implantátu je ešte vzdialené na niekoľko rokov. Implantát dávkuje inzulín intraperitoneálne - do dutiny brušnej a používa senzor, zavedený do veľkej žily. Implantácia sa robí chirurgicky a teda pacienta zaťažuje podstatne viac, ako inštalácia vonkajšieho umelého pankreasu. Napriek všetkým pokrokom, senzor má životnosť v trvaní niekoľko mesiacov a jeho výmena sa robí tiež chirurgicky. Všetky bežné problémy (upchatie pumpy, vyčerpanie batérii, porucha senzora atď., ktoré sú samozrejme schopné externé aj implantované zariadenia samostatne detekovať) sa na implantáte opravujú neporovnateľne ťažšie, ako na dobre prístupnom a ľahko vymeniteľnom externom zariadení. A je tu ešte jedno dodatočné riziko: zásobník obsahuje množstvo inzulínu, ktoré dokáže v prípade úniku ohroziť pacienta na živote masívnym predávkovaním. Tento únik ani tak nehrozí pri bežnej prevádzke, ako pri doplňovaní podkožného zásobníka. Hoci implantát splní všetky nároky na kvalitu liečby a pohodlie pacienta, jeho obsluha sa zatiaľ javí zložitejšia. Istou prekážkou zrejme bude aj vyššia cena.
Do bežného používania sa tak pomaly dostáva jedno z najdlhšie vyvíjaných lekárskych zariadení na svete.
Diskuze: