
Švédská Královská akademie věd udělila letošní Nobelovu cenu za chemii třem vědcům. Za paladiem katalyzované "křížové vazby" (cross couplings) v organické syntéze (for palladium-catalyzed cross couplings in organic synthesis) byli oceněni:
Richard F. Heck (University of Delaware, USA), Ejiči Negiši (Purdue University, USA) a Akira Suzuki (Hokkaidská universita v Sapporu, Japonsko).
Letošní "nobelovky" vzdávají hold nejen moudrým, kreativním, pracovitým a cílevědomým lidem, ale i chemickému prvku, jehož vlastnosti umožňují vytvářet nespočetné množství různých jednoduchých i složitých molekul. Díky tomu mohl vzniknout život tak, jako ho známe. Vytrvalému bádání Roberta Edwardse vděčí za šanci na život mnoho lidí (Nobelova cena za medicínu), Geim s Novoselovem objevili a prozkoumali zázračnou formu uhlíku - grafen (fyzika) a v chemii byla oceněna sofistikovaná metoda spojování dvou uhlovodíkových skupin přes jednoduchou uhlíkovou vazbu do složitější molekuly pomocí paladia. To umožňuje vytvářet nové, složitější chemické látky se širokým spektrem využití.
Není jednoduché přesvědčit některý z uhlíků v organické molekule, aby vytvořil chemickou vazbu s jiným uhlíkem v jiném uhlovodíku. Uhlík je relativně stabilní, proto chemikové museli najít způsoby, jako ho k takovému spojenectví přinutit pomocí „zprostředkovatele“. Tím může být katalyzátor, tedy látka, která chemické reakce vyvolává, vstupuje do nich, v jednotlivých krocích se mění, ale v závěru z celého procesu vychází ve své počáteční formě a tak se může účastnit dalšího cyklu.

Při chemické „konstrukci“ organické molekuly je (obecně vzato) její složitost přímo úměrná náročnosti cesty, která k ní vede. Dokazují to již 4 Nobelovy ceny, které byly uděleny za příspěvky k pokroku v této oblasti. Je více postupů, jenž umožňují syntézu komplexních molekul, ale v mnohých vznikají i nežádoucí vedlejší produkty, což může být problém při selekci hledané látky, zejména při „výrobě ve velkém“.
Syntéza typu "cross-couplings", ke které je nevyhnutná přítomnost katalytického kovu, například paladia, tento problém velmi elegantně řeší a pro chemiky představuje velmi účinný a využívaný nástroj, který proklestil nejdřív cestičku, pak dálnici do světa zbrusu nových látek.
Na jejím začátku bylo zjištění, že etylén (C2H4, ethen) na vzduchu v přítomnosti paladia oxiduje na acetaldehyd (C2H4O). To bylo podnětem k bližšímu prozkoumávání katalytických účinků tohoto nejreaktivnějšího z drahých kovů. Zanedlouho se začal intenzivně využívat pro spouštění reakcí, při nichž dvě organické sloučeniny si vymění prostřednictvím paladia své části tak, že v závěru, po redukci katalyzátoru, vzniká uhlovodík „složený“ pomocí jednoduché vazby uhlík – uhlík ze dvou uhlovodíkových skupin. Původně každá byla součástí jiné látky. Ze zbytků vstupních reaktantů vzniká vedlejší produkt.
Následující obrázek znázorňuje princip takzvané Heckovy reakce (zdroj: Scientific Background on the Nobel Prize in Chemistry 2010). Horní řádek je zkrácenou formou celého cyklu. V první sloučenině „R“ představuje uhlovodíkovou skupinu a „ X“ je halogenový, nebo trifluorometansulfonátový aniont. Jednoduchým příkladem „RX“ je chlorbenzen (ClC6H5), což je benzen (C6H6), který má jeden vodík nahrazený chlorem. Další reagující látkou je etylén C2H4, který má namísto jednoho vodíku uhlovodíkovou (alkylovou, vinylovou, nebo arylovou) skupinu R´: R´C2H3.
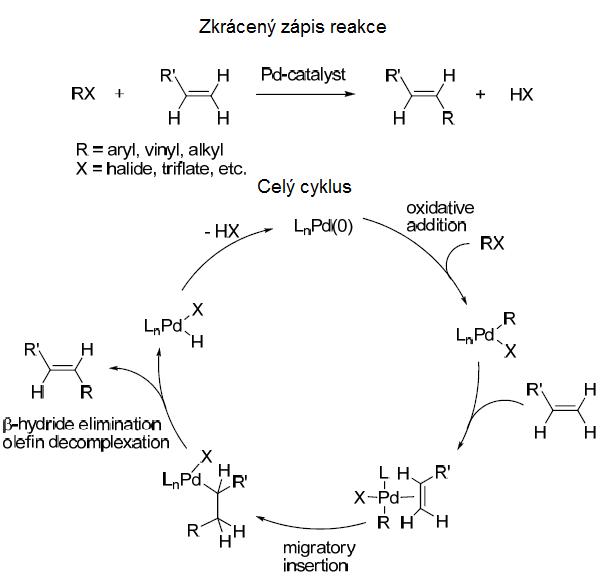

Když první látka RX přijde do kontaktu s paladiovým katalyzátorem (v cyklu jako LnPd(O)), vznikne meziprodukt R-LnPd-X. Průběh dalších reakcí po přidaní reaktantu R´C2H3 znázorňuje obrázek lépe než popis. Výsledkem celého cyklu je, že se v etylénu i další vodík nahrazuje uhlovodíkovou skupinou R a vzniká složitá molekula R´HC=CHR. Vedlejším produktem je látka HX, jako například HCl, HBr, kyselina trifluormetansulfonová... Z celého cyklu ještě vychází paladium ve stejné formě, v jaké do něj vstupovalo a tedy může nastartovat další kaskádu reakcí.
To je základní, dávno známý cyklus, který Richard Heck popsal v odborných publikacích vydaných v letech 1968-69. Stal se vydatným pramenem inspirace pro další výzkum a modifikace. Několik chemiků přispělo objevy nových katalytických reakcí, při kterých paladium nahradili jiným kovem, nebo testovali různé vstupní reaktanty - složitější organické molekuly, ve kterých již nějaký kov sehrával roli spojky dvou skupin v složitější molekule. Následující rovnice uvádí příklad:
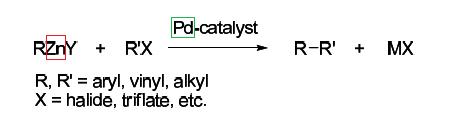
Tato reakce se nazývá Negišiho reakce a vstupní organická sloučenina obsahuje přechodný zinek, podobně jako následující Suzukiho reakce, jejichž vstupním reagentem je komplexnější organická sloučenina boru:
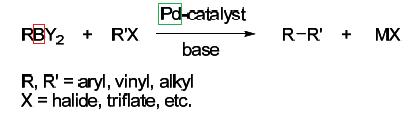
Jak Negiši a Suzuki modifikovali původní Heckovu reakci? Obrázek vpravo při pozornějším pohledu i nechemikovi prozradí, že do molekuly jedné vstupní látky R´X se mezi organickou uhlovodíkovou skupinu R´ a zbytek X (kterým může být jenom již zmíněný chlor, případně jiný halogenový aniont, anebo zbytek kyseliny trifluormetansulfonátové) naváže paladiový katalyzátor. V druhém reaktantu je také uhlovodíková skupina R navázaná na přechodní kov - zinek u Negišiho reakce, nebo bor u Suzukiho reakce. Právě tato organická část R v dalším kroku nahradí zbytek X na paladiu a výsledkem jsou dvě uhlovodíkové skupiny navázané některým svým uhlíkem na katalyzující kov. Po jeho redukci vzniká složitá organická molekula z obou uhlovodíkových skupin R-R´, které k sobě váže jednoduchá uhlíková vazba C-C.
Je to elegantní a efektivní způsob, jak „sestavit“ komplexnější organické molekuly, které se v přírodě nevyskytují. I když moderní chemie pramálo připomíná své romantické a často i dobrodružné alchymistické počátky, je to stále stejně vzrušující cesta poznávání způsobů a forem organizace hmoty do složitějších struktur. Snad nás jednou dovede i k odpovědi, jak se z jednoduchých organických stavebních prvků začal skládat život.
Pro ty, kteří se o paladiem katalyzované syntézy zajímají více, doporučujeme přehledný článek, jenž u příležitosti 74. narozenin Richarda Hecka v roce 2005 uveřejnil odborný časopis Angewandte Chemie.
Zdroj: nobelprize.org
Démoni modelování a hledání mimozemských plynů
Autor: Viktor Lošťák (03.05.2025)
Vědci poprvé v laboratoři pozorovali kvantovou superchemii
Autor: Stanislav Mihulka (09.08.2023)
První zřetelné snímky molekuly během chemické reakce
Autor: Stanislav Mihulka (03.06.2013)
Levitace a rotace ovládají strukturu molekul
Autor: Dagmar Gregorová (23.02.2012)
Existuje čtverná chemická vazba?
Autor: Tomáš Polívka (24.09.2007)
Diskuze:
Možná špatně chápu p. Mrázka?? Suzukiho reakci...
Ivan Kmínek,2010-10-11 15:19:18
můžete provést, jen pokud máte k dispozici kromě halogenované látky i sloučeninu s navázanou boronovou skupinou (nebo boronovým esterem). A tu mnohdy není vůbec snadné získat, připravuje se často v několika krocích dost klopotně, kolegové by mohli vyprávět. Čili pro ekonomicky výhodnou tvorbu vazeb uhlík-uhlík v jednoduchých sloučeninách, které lze získat jinak, je Suzukiho coupling zcela nevhodný, hodí se spíš pro syntézu chemických specialit. Další problém je samozřejmě cena paladiových katalyzátorů, i když jejich koncentrace při reakci může být velmi nízká, pokud se proces optimalizuje.
Díky autorce za propagaci pana Suzukiho...
Ivan Kmínek,2010-10-11 15:04:43
...a jím objevené reakce, kterou i já jako polymerní chemik často a rád používám, a to pro syntézy konjugovaných polymerů pro solární články, které by jinak v podstatě nešly "uvařit". Jen dvě poznámky k terminologii: 1) "halitový" ion je v češtině asi správně "halogenový ion". 2) I když se termín "křížová reakce" po oznámení Nobelových cen objevil v našich médiích, není to dobrý překlad anglického "cross coupling". V zásadě jde o spojení dvou různých molekul (ale může jít i o molekuly stejné) přes novou vazbu mezi 2 uhlíky, takže lepší by bylo asi něco jako Suzukiho spojovací reakce. Nicméně zavedený český ekvivalent asi zatím neexistuje, takže je zřejmě nejlépe používat původní slovo "coupling".
Dagmar Gregorova,2010-10-11 15:54:51
:)
upřimné DÍKY
Za halit - halogen se trochu stydím :(, to jsem vědět měla, kdysi jsem také chtěla studovat chemii, ale pak jsem skončila spíše u těch "halitů" :)
O této nobelovce se psalo asi nejhůř a asi je pro čtenáře nejméně stravitelná. Chápu, že cross couplings, i když je znám přes 40 let, nemá český odborný ekvivalent, nakonec jazykem vědy se stala angličtina. O tom hůře se ale pak věda popularizuje. Hybridní text se nedá dost dobře číst, uvědomuji si to, i když dělám dost časté výjimky v snaze být co nejpřesnější. Pojem coupling reakce asi laikovi nepoví o nic více, než například "speciální" reakce. Zkusila jsem zrušit všechny "křížové vazby", kromě podnadpisu, kde jsem je dala do uvozovek v snaze být v překladu co nejpřesnější. Jestli Vás napadne něco rozumnějšího, budu ráda. :)
Je tam zbytkové teplo a tím vyřešení energetiky ?
Jaroslav Mrázek,2010-10-11 10:45:06
Tím by padlo poslední omezení v získávání energie a lidstvo by mohlo začít uvažovat o absolutní energetické svobodě a nezávislosti a téměř zadarmo ... Je to ono ? Nebo se to vše bude teprve zkoumat, případně i "velmi dlouho"...?
Dagmar Gregorova,2010-10-11 11:42:03
:(
Žel reakce jsou ve většině případů endotermické, pro jejich průběh je kromě katalyzátoru nevyhnutná i vyšší teplota - závisí od typu reakce, ale řádově desítky st. Celsia až okolo 100-120 st. C.
Do chemických vazeb uhlovodíků se energie doslova ukládá a na tomto principu funguje fotosyntéza (pak je rozklad cukrů a škrobů zdrojem energie). Spalování fosilních paliv je uvolňováním části energie uložené fotosyntézou do uhlovodíků. I "umělá" tvorba uhlovodíků energii spotřebovává...
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce





