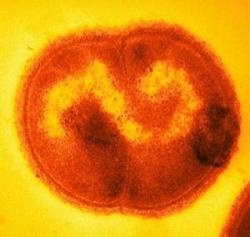
Deinococcus radiodurans je bakterie, která je vzácnou výjimkou – je extrémně odolná k ionizujícímu záření. A nejen to, kromě X, gama paprsků a UV záření se snadno vypořádává i s extrémním vysušením. Ukázalo se, že existuje jistá souvislost s akumulací manganu a odolností proteinu. Vědci přišli na to, že tekutina z rozbitých bakterií, která je ultrafiltrací zbavená všech proteinů, je schopna ochránit proteiny v buňce před oxidací při vysokých dávkách ozáření. Stejným způsobem připravený extrakt z příbuzného kmenu bakterií, které nejsou odolné, tento efekt nemá. V tekutině, která odolnost zprostředkuje, se vyskytuje mangan, fosfát, nukleosidy a peptidy. Roztok v laboratoři sestavený tak aby připomínal koncentrace látek v bakteriální buňce, je rovněž účinný. Manganové ionty (Mn2+) s ortofosfátem působí synergisticky a zvyšují odolnost enzymů pečujících o DNA. Filtrát připravený z odolných bakterií je schopen ochránit nejen neodolné bakterie Escherichia coli ale i lidské bílé krvinky. Děje se tak prostřednictvím Mn2+ -metabolických komplexů. Tyto komplexy chrání proteiny jak svých, tak cizích buněk. Je to cesta, jak s pomocí komplexů s ionty manganu lze cíleně zvyšovat odolnost proti oxidačním radikálům.
Za přirozených podmínek (bez ozařování) dokážou buňky ustát značné porušení svého genetického materiálu. Kvasinky jsou schopny si opravit stovky zlomů DNA (spontánně jim vznikají při meióze), bakterie ustojí desítky takových zlomů. U našich (lidských) buněk se odhaduje, že takových zlomů vzniká padesát v každém buněčném cyklu. Pokud ale obdobný počet zlomů navodíme u stejných buněk ionizovaným zářením, většinou to nepřežijí. Ozáření totiž poškozuje jak dvojšroubovici DNA, tak i proteiny zajišťující v buňce různé funkce, včetně oprav genetického kódu.
DNA
Molekulu DNA ionizující záření doslova rozláme. Pokud je porušeno jedno vlákno, nic moc se neděje, podle komplementárního vlákna lze „díru“ poměrně snadno zacelit. Problém je u zlomů, kdy jsou obě vlákna přerušena. Ať už se jedná o vyšší či nižší organismy, nárůst neopravených zlomů DNA způsobuje to, čemu vojáci říkají – bez spojení není velení. Chaos a metabolický rozvrat v takovém organismu s porouchanými geny pak vede k jeho zániku. Mezi organismy ale existují dost velké rozdíly v jejich odolnosti. Tak třeba u bakterie Shewanella oneidensis, k tomu aby uhynula, jí stačí vystavit dávce 70 Gy, což je tak málo, že to vyvolává v průměru jen jeden zlom DNA dvojvlákna v haploidnímu genomu. Na opačném konci pomyslného žebříčku odolnosti jsou bakteriální borci, kteří si hravě poradí i se stovkami takových zlomů.
Proteiny
Zatímco u bakterií archeí, virů, lidských i zvířecích buněk dojde k poškození DNA zhruba při stejné dávce ozáření (0.002–0.006 zlomů/Gy/Mbp na haploidní genom), u proteinů je tomu jinak. U těch poškození nezávisí ani tak na absorbované dávce záření, ale na takzvaném antioxidačním statusu. Radiací navozená oxidace proteinů je u citlivých bakterií až stokrát větší, než u těch rezistentních. Z tohoto pozorování vznikla hypotéza, že neodolné bakterie záření usmrcuje proto, že mají málo odolné opravné mechanismy neboli, že jejich proteiny jsou náchylné k oxidativnímu stresu. U zvláště odolných bakterií se ukazuje, že proteiny před oxidačním poškozením chrání „jakési“ komplexy, ty drží jejich enzymy jako v bavlnce a zajistí, že i při ozáření neklesá jejich aktivita. Tím je zachována i plná pohotovost a funkčnost opravářských čet v buňce.
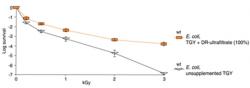
To, že i malá dávka záření znamená pro enzymy pohromu, se ví déle než půl století. Na vině je ionizace vody. Také se již delší dobu ví, že výluh z odolných bakterií je schopen jiné buňky částečně před vlivem záření ochránit. Jaká látka to způsobuje, zůstávalo záhadou. Najít odpověď na to, co za to může, se pokusil kolektiv pod vedením Michaela J. Dalyho, profesora na Uniformed Services University of the Health Sciences (USU). Jejich práce vyšla v časopisu PLoS ONE. Objektem jejich zájmu se stala také bakterie Deinococcus o níž se vědělo, že má geny zapakované do čtyř identických kruhových chromozomálních smyček, což jí dovoluje seřadit kopie identických genů jeden vedle druhého. To umožňuje bakteriálním enzymům opravovat porušené sekvence jednoho genu kopírováním těch neporušených podle sousedního genu. Na čem je ale založen mechanismus přenosu odolnosti z jednoho bakteriálního kmene na jiný pouhým přenosem látek obsažených v cytoplasmě, se toho mnoho nevědělo. Pátráním po látce zajišťující odolnost začal Dalyho tým stejně jako jejich předchůdci - homogenizací odolných bakterií. Rozdíl byl jen ve způsobu zpracování vzniklé bakteriální břečky – konkrétně v jejím odstřeďování a filtraci. Tentokrát měli vědci k dispozici zvlášť účinné ultracentrifugy a filtraci. Jinak řečeno, tentokrát mohli z roztoku odstranit všechny proteiny a také všechny peptidy větší než 1 kDa. Stejným způsobem připravili ultrafiltrát jak z těch odolných, tak neodolných bakteriálních kmenů. Tím měli kontrolu a dál už jen zjišťovali, která z frakcí je schopna aktivitu enzymů ochránit. Toto zjednodušení – pracovat jen s enzymy - si mohli dovolit, protože enzym vezmou při ozařování za své jako první. Ultrafiltrát přidávali k enzymům o známé aktivitě a o nichž věděli, že jsou náchylné k oxidaci aktivním kyslíkem a pak směs vystavili záření. Přípravek z bakteriálních těl připravený z odolných bakterií i po ultrafiltraci (tedy bez proteinů) se ukázal být vysoce účinným prostředkem ochrany proti nežádoucímu působení volných radikálů – tedy látek, které opravné enzymy vyřazují ze hry.
Odolná bakterie má tedy proti ionizujícímu záření dvě zbraně. Jednou je formování jejích chromozómů, což okoukat a využít v náš prospěch dost dobře nejde. Druhou zbraní je účinný opravný mechanismus. Hovořit o výhodách případného využití takových mechanismů k nápravě škod, které nám způsobují genotoxické materiály, by bylo zbytečné.
Mangan ve formě komplexů
Z rozborů vodných výluhů z bakterií (ultrafiltrátů) brzo vyšlo najevo, že prsty v ochraně buněk má mangan. Zatímco obsah ostatních kovů v cytosolu byl zhruba stejný, manganu měly odolné bakterie 15 – 150 x více. Zajímavé na tomto „manganu“ je, že zatímco jiné kovy, jako například železo, které je v cytosolu buněk také vázáno na proteiny se dají vysrážet kyselinou trichloroctovou, většina „manganu“ je proti tomuto zákroku razantního rozpouštědla odolná. To do jisté míry charakterizuje, o jakou látku jde. Není to jednoduchá sloučenina ale složitý komplex. Zvláštní na něm je, že zůstává ve vodné fázi a že molekuly manganu jsou v tomto komplexu navázány na titěrné molekuly (menší než 3 kilodaltony). Součástí komplexu jsou navíc peptidy. Z chemického pohledu tyto komplexy fungují jako antioxidanty. Dokážou se účinně vypořádat s hydroxylovými radikály (HO*), které vznikají při tom, když katalyticky likvidují škodlivé superoxidy (O*-). Součástí těchto složitých komplexů jsou některé aminokyseliny a také peptidy. Zdá se, že dělba práce v tomto komplexu je následující - aminokyseliny a peptidy pomáhají s likvidací a úklidem hydroxylových skupin a mangan (Mn2+) katalyzuje rozklad peroxidů (H2O2). Právě peroxidy vzniklé působením ionizujícího záření páchají v buňce nejvíce nenapravitelných škod – vyřazují z činnosti enzymy, které pak nemohou opravit poškozenou DNA.
"Sprostá" syntetická náhražka
Složité komplexy, které se vyskytují v cytosolu odolných bakterií v laboratoři sestavit samozřejmě nedovedeme. Vlastně ani dosud přesně neznáme složení ultrafiltrátů. Zkoumání jejich vlastností ale tak trochu dalo představu, co v buňce zajišťují a tak následovaly pokusy zlepšit vlastnosti bakterií nejen ultrafiltrátem se složitými komplexy, ale jeho syntetickými náhražkami. Jedna z variant je kupodivu snadno sestavitelná a přitom vysoce účinná. Také dokáže při ozařování zachovat aktivitu enzymů, podobně jako ultrafiltrát a také jako on ochrání před poškozením ohrožené buněčné proteiny. Základem syntetické náhražky je fosfátový pufr udržující pH na hodnotě 7,4. Dále pak dva nukleotidy - uracil a adenin a samozřejmě mangan ve formě dvoumocných iontů (MnCl2).
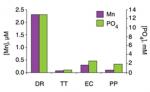
Vylepšování ochranného prostředku o ionty vápníku, železa, niklu, mědi a zinku žádný ochranný účinek nevyvolalo. Udělat z citlivých buněk vysoce odolné borce tedy lze snadno a to pouhým dodáním běžných a levných syntetických látek do jejich živné půdy. Když se zde popsaná směs manganu, aminokyselin a uridinu obohatí ještě dimetylsulfoxid (DMSO), počet ozářených přeživších bakterií rázem vzrostl 10 000krát (!).
Samozřejmě, že Dalyho tým se také pokusil najít na svém poznatku i něco prakticky aplikovatelného. Vyzkoušeli, zda jejich extrakt z mangan akumulujících bakterií by neochránil i lidské lymfocyty. Výsledek je velmi nadějný. Extraktem ošetřené bílé krvinky odolávaly dávce 16 Gy, ta jinak spolehlivě zabíjí 50 % lidských buněk.
Závěr
Vědcům se podařilo zjistit, co dělá bakterie vysoce odolné proti ionizujícímu záření. Tuto odolnost se jim podařilo přenést z jedněch bakterií na jiné, které přirozeně odolné nejsou. Ukázalo se, že odolnosti buněk lze dosáhnout jak pomocí složitých komplexů obsažených ve vodném extraktu z bakterií, tak i aplikací směsi sestavené z několika málo syntetických látek - chloridu manganatého, fosfátu a dvou nukleotidů. Za pomoci „syntetiky“ se podařilo vysoce zlepšit schopnost opravovat poškozenou DNA a tím i odolnost proti radioaktivitě i u lidských buněk. Zdá se, že si v budoucnu budeme moci vylepšovat nejen genetický kód, ale i opravné mechanismy, které mají na starosti jeho bezchybnou funkci.
Pramen: Service University of the Health Sciences (USU), PLoS ONE.
Poznámky
Dávka ionizujícího záření (absorbovaná dávka) je definovaná jako poměr střední energie předané ionizujícím zářením látce o dané hmotnosti. Základní jednotkou absorbované dávky je gray (Gy) - odpovídá J.kg-1. Je to energie 1 joule absorbovaná v kilogramu látky.
Dávkový ekvivalent (H) se týká biologického účinku různých druhů ionizujícího záření. Jednotkou je sievert (Sv) - odpovídá J.kg-1. Starou jednotkou byl rem: 1 rem = 0,01 Sv.
Buňku nejvíce poškozuje ionizující záření (rentgenové a gama) nepřímo a to tím, že rozkládá v cytoplazmě vodu (H2O→HO•+H+ [proton]+e−); H2O2 (2 HO• → H2O2); a O2•− aniony (O2+e− → O2•−). Zatímco hydroxylové skupiny (HO•) jsou vysoce reaktivní a “žijí” jen krátce (také proto buňce škodí o něco), O2•− a H2O2 jsou relativně inertní a v buňce dělají škodu dlouho, jsou pro ní tedy větší hrozbou. Nejvíce škod páchají na proteinech. Zvláště těch, které obsaují skupinu krevního barviva – hem, nebo cystein a všude tam, kde molekula kovu hraje úlohu katalyzátoru, což jsou místa náchylná k oxidaci.
DMSO = dimetylsulfoxid (molekulární vzorec C2H6OS) je sloučenina, která dokáže eliminovat hydroxylové ionty. Bakterie E. Coli neumí tuto látku rozkládat.
Diskuze:




