Nové poznatky svědčí o tom, že když se prionový protein (PrP) začne hromadit v nesprávném místě buňky, začne laškovat s jiným proteinem - mahoguninem. Spojení obou proteinů je ale pro buňku vražedné. Tuto zatím poslední verzi škodlivosti prionových neurodegenerativních nemocí zveřejnilo nové číslo časopisu Cell.
Proteiny jsou molekuly poskládané z celé řady aminokyselin. Protože jsou molekuly dlouhé, musejí se pečlivě skládat. Nejedná se jen o pouhou úsporu místa. Proteinové skládačky se tak trochu podobají složitým origami a jejich cílem je určitý tvar. Terciální struktura proteinu totiž má co mluvit do funkce molekuly. Nesprávné poskládání znamená často patologický stav.
A tak nás nepřekvapí, že zašmodrchání jednoho z proteinů má za následek nemoci, jakými jsou u skotu BSE, nebo lidská Creutzfeldt - Jakobova choroba. Týká se to proteinu, kterému se říká prionový protein. Pokud se zašmodrchá, už se mu neříká prionový protein, ale je to prion. Zákeřnost těchto nemocí spočívá v tom, že po nabytí své nové (zašmodrchané) formy se stávají infekčním agens.
Člověk se pak může nakazit potravou a nemoc se u něj projeví jako variantní Creutzfeld Jacobova nemoc (vCJD). Onemocnět prionovou chorobou se ale dá i jinak. Nemusí to být jen pozřením infikovaného masa. Na vině může být i nešťastná genetická mutace. Ať tak, či tak, nesprávně poskládané proteiny buňkám nesvědčí.

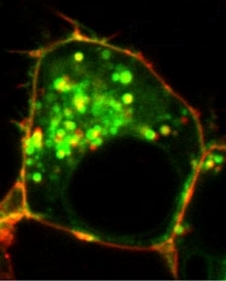
Co buňce při prionové chorobě škodí, se pokusili vědci objasnit v laboratořích Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD). Z jejich pokusů vyplývá, že prionový protein začne buňce stěžovat život tehdy, když místo toho, aby plnil své funkce jako normální součást povrchové buněčné membrány, začne se hromadit v cytoplazmě. To, co buňku nakonec zničí, je protein v nesprávném místě. Dále vyšlo najevo, že prionový protein v cytoplazmě neškodí sám. Má vydatného pomocníka. Je jím mahogunin a vyloučit v tuto chvíli nejde ani to, že by jich mohlo být i více.
O nové poznatky se vydatně zasloužily myši s mahagonovou srstí. Kromě barvy svých chlupů jsou tato zvířata zajímavá tím, že ačkoli se zpočátku vyvíjí normálně, činnost jejich nervového systému se s postupujícím věkem rychle zhoršuje. V jejich mozcích se brzo vytvoří díry jako v ementálu. Mozek těchto zvířátek začne záhy odumírat stejně, jako mozky zvířecích či lidských pacientů po infekci prionů. To nejdůležitější na těchto myších je, že se přitom v jejich případě nejedná o infekci prionů. To, co má tento myší kmen defektní, je pouze gen pro mahagonovou barvu srsti. Vědci jej nazvali „mahogunin“.
Myšlenku, že prionová choroba by mohla souviset s poruchou dalšího proteinu (mahoguninu) vyplynula z podobnosti patologických nálezů na myších mozcích nakažených infekčních prionem a mozků „zdravých“ mahagonových myší. K potvrzení své hypotézy o problémech plynoucích z nedostatku mahoguninu, vědci zjišťovali, jak se oba proteiny v buňkách chovají. Zkoušeli ledasco. Dokonce i pěstování myších buněk na Petriho miskách. Když do cytoplazmy buněk od zdravých myších buněk „nacpali“ změněný prionový protein, molekuly mahoguninu se s ním začaly družit a vytvářet společné shluky. U takto ošetřených buněk došlo ke stejnému poškození, jaké postihuje buňky, jež mají v důsledku genetické poruchy v cytoplazmě mahoguninu málo.

Dalším poznatkem týkajícím se škodlivost prionů souvisí s jejich distribucí v buňce. Když se prionový protein v buňkách hromadil jen v povrchové vrstvě buněk, k jejich poškozování nedošlo. Stejně tak buňky ochránilo, když je vědci začali dopovat dodatečnými dávkami mahoguninu. A nebo když zabránili, aby se prionový protein s mahoguninem spojoval.
Jaké by to dnes byly pokusy, kdyby se při nich nepoužívaly geneticky modifikované organismy. V tomto případě šlo o myši, jimž vědci přivodili nemoc, které se u lidí říká GSS (Gerstmann-Strausslerův-Scheinkerho syndrom). Jde o vzácnou dědičnou neurodegenerativní prionovou chorobu, na níž se umírá ve věku mezi čtyřiceti až šedesáti lety. O této nemoci se ví, že nastává vlivem mutace a že se při ní povrchový prionový protein dostává do kontaktu s cytoplazmou. U myší, které mají stejnou mutaci jako nemocní lidé, se začalo projevovat strádání mozku v důsledku nedostatku mahoguninu. Když takto nemocným myškám upravili prionový protein tak, aby nedocházelo k jeho kontaktu s cytoplazmatickými strukturami, buňky přestaly strádat a nedostatkem mahoguninu netrpěly.
Vědci z těchto pokusů nabyli dojmu, že to, co mozek poškozuje, by mohla být reakce změněného prionového proteinu s mahoguninem. Přitom nevylučují, že poblázněný prionový protein v cytoplazmě by mohl tropit neplechu i s dalšími tamními proteiny. Ztráta funkce mahoguninu se jim ale pro buňku jeví jako klíčová.
Vědci nyní plánují další pokusy. Chtějí pochopit mechanismus, jakým prionový protein mahogunin vyřazuje ze hry. Slibují si od toho dvě věci. Mohli by přijít na způsob jak buňce pomoci aby se jí znovu začalo dařit prionový protein z cytoplazmy odstraňovat. Případně by mohli najít cestu, jak do buněk dostat extra porce mahoguninu. I to by mohla být cesta, jak eliminovat jeho úbytek v důsledku řádění zlého prionového proteinu. Obě cesty by mohly znamenat obrat v naší bezmocnosti v boji se zhoubnými prionovými chorobami.
Pramen: NIH/National Institute of Child Health and Human Development.
Cell, 2009; 137 (6): 1136 DOI: 10.1016/j.cell.2009.03.042
Severoamerická zombie choroba jelenů by se mohla šířit mezi lidi
Autor: Stanislav Mihulka (24.02.2019)
Navádí Parkinsona vagus?
Autor: Josef Pazdera (02.05.2017)
Paměť je vlastně jen šílenost pod kontrolou
Autor: Josef Pazdera (03.07.2015)
Ze zloducha klíčový hráč evoluce
Autor: Josef Pazdera (11.06.2012)
Nová prionová choroba se jmenuje VPSPr
Autor: Josef Pazdera (16.08.2010)
Diskuze:



