
Fluoreskující proteiny jsou na mediálním poli evergreenem. Začalo to se zelenou medůzou a teď již fluoreskují myšky, králíci, kočky, prasátka, psi a nechybí ani ryby. Akvaristé obchodují s geneticky modifikovaným dániem pruhovaným (Danio rerio). Zatímco u nás, všichni, kdož tuto svítící rybku chovají se podle ČIŽP vystavují postihu a vysoké pokutě za neoprávněné nakládání s nepovoleným geneticky modifikovaným organismem podle zákona č.78/2004 Sb., Stanovisko Food and Drug Administration (FDA), což je americká organizace dohlížející na bezpečnost potravin a léků, je náledovné: “Akvarijní ryba se nejí a tak nepředstavuje z hlediska bezpečnosti potravin riziko. Také neexistuje žádný důkaz, že by geneticky modifikovaná ryba představovala pro životní prostředí větší riziko než běžně chovaný nemodifikovaný jedinec“. Ne vždy ale vědci vymýšlejí legrácky pro akvaristy a legislativce, většinou na zvířátkách se „svítícími“ proteiny v těle sledují funkce nejrůznějších molekul a genů.

Na počátku byla medůza
Fluoreskující proteiny jsou zvláštní látky. Nejprve světlo absorbují a poté jej se zpožděním emitují. Jde o to, že záření o kratší vlnové délce (větší frekvenci) vyvolává v látce vznik záření o delší vlnové délce (nižší frekvenci). Objev a vývoj zeleně fluoreskujících proteinů byl v roce 2008 oceněn Nobelovkou za chemii. Podrobně o oceněných pokusech referoval Osel článku „Nobelova cena 2008 za chémiu“. Přes veškeré úspěchy mají fluoreskující proteiny jeden handicap. Potřebují být excitovány modrým až oranžovým spektrem viditelného světla. Vlnovou délkou 495 až 570 nanometerů. Světlo o této vlnové délce je příliš krátké na to, aby dobře procházelo tkáněmi a tak zeleně fluoreskující proteiny jsou převážně využívány ve studiích odečítajících výsledky testu ve zkumavce, k zobrazení dělení buněk a nebo ke značení různých buněčných typů.
Pro metody optického zobrazování in vivo dějů je nejvhodnější světlo o vlnové délce mezi 650 až 900 nm. V tomto rozsahu je minimální absorbance hemoglobinu, vody a tuků a eliminuje se rozptyl paprsků. Excitační a vyzařovaná maxima fluoreskujících proteinů dosud nepřesáhla 598 a 655 nm. O něco delší vlnové délky (644 nm při excitaci a 672 nm při vyzařování) byly pozorovány u fluoreskujícího proteinu odvozeného od fytochromu vázajícího jako chromofor látku phycocyanobilin (PCB).
V praxi se tato látka neujala a tak bakteriální fytochromy jsou v tomto směru slibným řešením protože místo PCB obsahují jako chromofor biliverdin (BV) Ten je základním meziproduktem fyziologických pochodů u všech aerobních organismů. Je rozpadním produktem krevního barviva hemu.
Jeden z nobelistů Roger Y. Tsien z University of California, San Diego publikoval se svými spolupracovníky v nejnovějším čísle časopisu Science práci s nově vyvinutým fluoreskujícím proteinem, který umožňuje označovat a zviditelňovat aktivity buněk tak jak probíhají v těle živých zvířat. Poté, co protein absorbuje světlo z oblasti konce červeného spektra, fluoreskuje v oblasti blízké infračervené světlo na vlnové délce okolo 700 nanometrů.
Delší vlny dokáží pronikat savčími tkáněmi. Ani kost jim není překážkou. Pokud označíme nádorové buňky zeleným proteinem a nádor bude ukryt kdesi v hloubi těla, nic neuvidíme. Zelená fluorescence nemá šanci se tkáněmi prodrat na povrch a poskytnout nám příslušnou informaci. Infračerveně fluoreskující proteiny jsou schopny podat mnohem jasnější a přesnější obraz toho, co se uvnitř těla děje.
Jak se fluoreskující proteiny používají?
Představa, že se svítící proteiny používají jako nějaká látka, která se do těla aplikuje, by byla mylná. Používá se pouze gen. Gen pro bioluminiscenční protein se připojuje ke genu, který, který hodláme zkoumat a jež za normálních okolností tvoří jen „neviditelnou“ bílkovinu. Chceme-li, aby začala fluoreskovat, musíme tedy do organismu vpašovat příslušný gen a zkoumaný objekt se stává geneticky modifikovaným organismem, který začne „svítit“. Zpočátku se jednalo o barvu zelenou, později červenou, nově jde v tomto případě o infračervené spektrum. Nový způsob je zvláště vhodný ke zjišťování aktivních genů v buňkách, kam které buňky cestují, v jakých orgánech (tkáních) se usazují,…
Kde se svítící protein dá sehnat?
Vědci infračerveně fluoreskující protein získali z bakterie Deinococcus radiodurans. Jde o velmi zajímavou bakterii - extrémofil odolávající nepříznivým podmínkám. To nás ale v tomto případě nezajímá. Ve skutečnosti tato bakterie ani nemá žádný protein, kterým by si svítila a už vůbec ne infračerveně. Bakteriální fytochrom, tedy protein o kterém je zde řeč, má bakterie na to, aby si s jeho pomocí přeměňovala světlo na energii. Obdobné fytochromy známe i u rostlin. Jejich prostřednictvím si rostliny některé geny zapínají, jiné uspávají. Spouštěcím signálem je zde světlo. Podle toho například květ zjistí kdy a kam se má natočit. Rostliny i bakterie s jejich pomocí přelaďují svůj metabolismus na denní a noční činnost. Jde o opakující se cyklické děje. Fytochromy jsou definovány jako molekuly, které jsou schopny získat energii a řídit expresi genů.
Ačkoli se nám vpravování genů s cílem vyvolat v tkáních fluorescenci může zdát zvrhlé, stále více poznatků svědčí spíše o opaku. Nemusí se jednat o nijak zvláště velký zásah do organismu. Svědčí o tom pokusy na různých živočišných druzích. Všechny je velmi dobře snášely. To, že jsme v minulosti mohli mít ve věci těchto proteinů dost společného, vyplývá i z nedávného zjištění americko-japonského výzkumného týmu. Našli fluoreskující protein i u kopinatce.
Rybě podobný tvor patří do strunatců. Struktura jeho svítícího proteinu je podobná struktuře, kterou tvoří koráli. To ale znamená, že tu máme dva kmeny (strunatce a žahavce), které od sebe dělí miliony let samotného vývoje a přesto si uchovali gen a jeho protein a to prakticky beze změny. Gen i jeho produkt si chrání proti náhodným mutacím. Takové evoluční „konzervy“ se většinou týkají něčeho důležitého a tak tyto proteiny nemusí být cizí ani nám – lidem, jsme totiž také strunatci. Je tu domněnka, že nás chránily před ultrafialovým zářením.
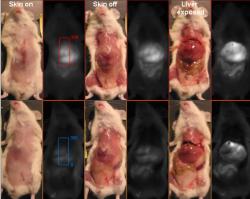
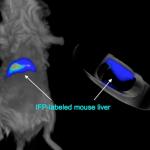
V případě infračerveně fluoreskujícího proteinu jde o bakteriální záležitost. Samotný protein, tak jak se v bakterii vyskytuje, by pro vědecké účely byl k ničemu. Přírodu bylo třeba trošku předělat. Základní krok spočíval v úpravě bakteriálního fytochromu, aby po absorbci světla jej emitoval, místo jeho využití jako zdroje energie (což je jeho původní funkce). Výzkumníci se s tím moc nemazlili a části proteinu, který přijaté světlo mění na chemickou energii jednoduše odstřihli. Aby nedošlo ale k mýlce, takto se to píše v populárních článcích. Ve skutečnosti se stříhání dálo na úrovni genomu a to v místě odpovědném, za kódování příslušného proteinu. Pochopitelně, že po takto brutálním zákroku vznikl gen mrzák tvořící postižený protein neschopný přijatou energii zpracovat. To ale záměru zcela vyhovuje neboť dodanou energii protein uvolňuje ve formě infračerveného světélkování. Máme-li jednou takový gen k dispozici, byť by byl původem bakteriální, můžeme s ním začít kouzlit. Například jej vkládat do genomu myši. Pokud jej „přilepíme“ na gen, jež je aktivní (tvoří nějaký protein specifický pro jaterní buňky), začnou játra světélkovat. To také vědci udělali. Když se takto geneticky upravená myš nasvítí červeně, její jaterní buňky začnou zářit ve spektru blízké infračervené.
Definice pro odborníky
Nová barvička je bakteriální fytochrom z Deinococcus radiodurans s navázaným biliverdinem jako chromoforem. Fytochrom lze navázat do monomerických infračerveně-fluoreskujících proteinů (IFP) s excitačním a vysílaným maximem ve vlnových délkách 684 a 708 nanometrů.
K čemu to je
Využití by nové poznatky měly dojít u živých organismů a to zviditelněním široké škály biochemických procesů. Přímé použití této metody u člověka je ale nepravděpodobné. Vyžaduje totiž genovou terapii a jak známo, vkládání bakteriálních genů do lidského genomu je eticky přinejmenším diskutabilní. U zvířat ale pokusy s proteinem mají zelenou (vlastně „infračervenou“), protože tento přístup vědce zbavuje velkého problému - přirozeného světélkování proteinů. Jde o to, že když na tkáň (prakticky jakoukoliv) posvítíme, vrací nám světlo na vlnových délkách podobných těm, na kterých světélkují konvenční fluorescenční proteinové markery. Tento přirozený „nespecifický svit“ proteinů při zkoumání tkání vadí. Říkáme, že tkáně mají vysoký světelný „šum“.
Od této molekuly se očekává mnohem více
Velké naděje jsou vkládány do případného využití původní funkce bakteriálního fytochromu. Jak jsme již v tomto článku výše popsali, fluoreskující protein byl připraven z proteinu, který měl za úkol (když na něj dopadalo světlo), nějaké ty geny zapnout a uvést v činnost, jiné zase utlumit. Řídil v buňce metabolické děje. Protože vědci tuto jeho aktivitu ke svým záměrům nepotřebovali, příslušnou část „odstřihli“. Teoreticky by vrácení funkce - spouštění genové exprese, neměl být takový problém. Mělo by být schůdné připravit molekulu (rozuměj gen, který by protein tvořil), jež by si funci řídícího signálu ponechala. Takový protein by nám dovolil spouštět geny a řídit biochemické pochody v organismu pomocí světla příslušné vlnové délky.
V plánech vědců je již zapínání genů u nichž se předpokládají mozkové funkce. Na myších by se mělo sledovat, jak se jejich aktivita projevuje v chování jedince. Obdobné pokusy se v neurovědě dělaly a dělají, ale nyní by k nim nebylo třeba otvírat zvířatům lebku ani zavádět do mozku jehly s elektrodami. Pokud se podaří vrátit fluoreskujícímu proteinu jeho funkci a udělat z něj zmíněný fytochrom, pak by šlo geny zapínat uvnitř orgánů dle libosti. Stačilo by na ně jen posvítit vlněním procházejícím dobře tkáněmi a chvíli počkat, než příslušný gen „sepne“. Odhalování funkcí genů s takovým nástrojem má šanci rychle pokročit.
Prameny:
Connecticut College
http://www.conncoll.edu/ccacad/zimmer/GFP-ww/GFP-1.htm
Science 8 May 2009: Vol. 324. no. 5928, pp. 804 – 807 DOI: 10.1126/science.1168683
Diskuze:



