
Prírodnému „vynálezu“ fotosyntézy vďačíme za súčasnú rozmanitosť pozemského života. Táto foto-bio-chemická reakcia umožnila aj našu existenciu. Rastliny jej prostredníctvom získavajú energiu z anorganického okolitého prostredia a uchovávajú ju v chemických väzbách, napríklad glukózy:
6CO2 + 6H2O (+ slnečná energia) = C6H12O6 + 6O2
Celý fascinujúci mechanizmus je však oveľa zložitejší a vyvíjajúci sa už miliardy rokov. (Odporúčame stránky v češtine: heslo Fotosyntéza na stránkach Wikipedie a v slovenčine: ročníkovú prácu Miroslava Genského, bývalého študenta Gymnázia Jána Adama Raymana v Prešove.)

Energetická účinnosť fotosyntézy je asi 34%. No v porovnaní s doposiaľ rekordnými, asi 40timi percentami miniatúrnych a zatiaľ len experimentálnych fotovoltaických článkov to nie vôbec málo. Rastliny sa však „vyrábajú“ samé, neraz aj proti našej vôli, majú pre nás estetickú hodnotu, produkujú kyslík, či slúžia ako potravinový zdroj energie. Ich porovnanie s malým, nákladne vyprodukovaným fotočlánkom s obsahom látok ako sú fosfidy, či arzenidy gália a india tak kríva na obe nohy. Máme sa stále od prírody čo učiť. Medzi tých, ktorí v nej hľadajú inšpiráciu patrí aj chemik Heinz Frei a stážujúci postdoktorand Feng Jiao z Oddelenia pre energie amerického Národného laboratória Lawrenca Berkeleyho (Berkeley Lab). Koncom januára uverejnili v odbornom časopise Angewandte Chemie prácu „Nanostructured Cobalt Oxide Clusters in Mesoporous Silica as Efficient Oxygen-Evolving Catalysts“. Možno práve táto práca je prvý reálnym krokom na ceste k umelej fotosyntéze, pri ktorej z kysličníka uhličitého a vody vznikne uhľovodíkové palivo a to len za pomoci slnečnej energie a katalyzátora. Palivom by mal byť metanol (metylalkohol, CH3OH) a rovnicami by sa celý dvojfázový proces dal zjednodušene zapísať:
2 H2O → O2 + 4 e- + 4 H+
CO2 + 3 H2 → CH3OH + H2O
Obe chemické reakcie vyžadujú energiu a prítomnosť katalyzátora – látky, ktorá vyvoláva, alebo aspoň výrazne urýchľuje chemickú reakciu tým, že počas nej vytvára so vstupnými reagujúcimi látkami nestabilný medziprodukt, ale v závere reakcie z nej vystupuje opäť nezmenená v pôvodnej forme. Práve objav vhodného katalyzátora je míľnikom na polceste k cieľu a výsledkom mnohých experimentov Freia a Jiaoa. Po nespočetných pokusoch odhalili, že zhluky drobných kryštálikov podvojného oxidu kobaltnato-kobaltitého (Co3O4) nanometrových rozmerov, teda milióntin milimetra, sú tým najefektívnejším katalyzátorom pri rozklade molekúl vody pomocou svetla (fotolýze) na kyslík, elektróny a jadrá vodíka – teda pre prvú z uvedených reakcií. Vydrží bez degradácie dostatočne dlho, je dostupný a zároveň dokáže dostatočne účinne a rýchlo využiť energiu fotónov.
Výsledkom celého procesu umelej fotosyntézy by však malo byť tekuté palivo. Dosiahnuť cieľ znamená vyriešiť nielen fotolýzu vody, ale aj druhú časť procesu – katalytickú fotosyntézu kysličníka uhličitého s vodíkom na metanol, aj prípadné problémy s jeho manipuláciou a uskladnením. Je tekutý, ale aj prchavý a jedovatý. Vyriešenie týchto úloh by znamenalo dosiahnuť takmer uzavretý cyklus využitia dostupných vstupných surovín – kysličníka uhličitého a vody. Ak z nich pomocou slnečnej energie vyrobíme metanol, časť solárnej energie tým „uväzníme“ jeho molekulách.
Pri spaľovaní metanolu vznikajú opäť pôvodné látky - voda a CO2. Zo vzduchu sa síce pritom odoberá kyslík, ale ten sa predtým uvoľnil pri fotolýze vody – v prvej z reakcií. Takže v ideálnom prípade by sme takto mohli napríklad jazdiť v autách síce so spaľovacím motorom, ale v podstate na slnečnú energiu, získavanú pomocou cyklu CO2 + H2O → CH3OH → CO2 + H2O.
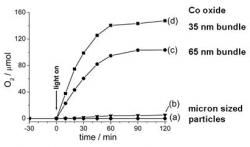
Rastliny si vytvorili listy ako biochemické slnečné kolektory. Umelá fotosyntéza bude tiež vyžadovať zariadenia, vystavené slnečným lúčom. Ale ako na to? Rastliny rozklad vody katalyzujú enzýmami, ktoré obsahujú mangán. Vedcom sa najviac osvedčili kysličníky irídia, ale pretože je to veľmi vzácny prvok na zemskom povrchu, nebola táto cesta pre praktické využitie schodná. Kobalt a jeho kysličníky boli ďalšou nádejnou katalytickou látkou. Frei a Jiao dlho testovali vhodnú veľkosť kryštálov a ich vzájomné usporiadanie, pretože pri ich mikrometrových rozmeroch (tisíciny milimetra) reakcia neprebiehala dostatočne rýchlo a efektívne. Ďalšími testami však odhalili, že zmenšovaním rozmerov kryštálikov podvojného oxidu kobaltnato-kobaltitého (CoO x Co2O3 – sumárny vzorec Co3O4) sa účinnosť katalýzy rapídne zvyšuje. Pre zoskupenie častíc nanometrových rozmerov sa účinnosť reakcie zvýšila 1 600 násobne v porovnaní s väčšími, mikrometrovými časticami. Za sekundu jedna skupina nanočastíc dokázala z vody uvoľniť 1 140 molekúl kyslíka. Ako zdroj energie, poháňajúcej fotolýzu vedci používali svetelný zdroj s výkonom asi 1 000 wattov na štvorcový meter (1 000 joulov za sekundu na meter štvorcový), čo približne odpovedá intenzite slnečného svetla na zemskom povrchu.
Vo vodnom roztoku sa nachádzajú asi 35 nanometrov veľké častice kysličníka kremičitého (materiál z ktorého je čistý prírodný kremeň), v ktorých sa nachádzajú zväzky rovnobežne usporiadaných stĺpcových kryštálikov oxidu kobaltnato-kobaltitého (Co3O4) a senzibilizátor. Po ožiarení roztoku laserovým svetlom, senzibilizátor absorbuje svetlo a roztok sa zafarbí na modro. Bublinky ktoré sa v roztoku vytvárajú sú prejavom fotolytického rozkladu vody.

Pri tvorbe vhodných nanokryštálov oxidov kobaltu vedcom pomohlo „lešenie“ z porézneho kremenného materiálu (oxidu kremičitého, SiO2). Využili systém rovnobežných kanálikov nanometrových rozmerov, ktoré sa v tomto materiáli vytvárajú prirodzenou cestou a vyplnili ich roztokom, z ktorého v týchto dutinách Co3O4 vykryštalizoval. Výsledný tvar jeho drobných kryštálikov inverzne kopíruje poréznu štruktúru kremenného skeletu a vytvára skupinu – zväzok rovnobežných drobných tyčiek s priemerom 8 nanometrov a dĺžkou 50 nanometrov, ktoré sú pospájané krátkymi jemnými priečnymi mostíkmi – pozri obrázok. Najvyšší katalytický účinok dosahujú skupiny týchto Co3O4 kryštálov pri priemere 35 nanometrov. Ak je tento rozmer väčší, účinnosť klesá.
„Efektivita, rýchlosť a rozmery našich skupín (klastrov) nanokryštálov oxidov kobaltu je porovnateľná s mechanizmom „fotosystému II“ (poznámka pod článkom)“, tvrdí Heinz Frei. „Ak zrátame dostupnosť oxidov kobaltu, funkčnú stabilitu katalyzujúcich skupín nanokryštálov, malé elektrické napätie (350 mV), len mierne nižšie pH (5,8) a izbovú teplotu (22oC), faktory postačujúce na priebeh reakcie, sme presvedčení, že máme sľubný katalytický článok pre vývoj funkčného, komplexného, slnkom poháňaného systému na získavanie paliva.“
Fotosystém II je prvým komplexom bielkovín, ktoré vstupujú do fotosyntézy. Enzýmy využívajú fotóny svetla na rozklad vody. Kyslík sa uvoľní do atmosféry, vodíkové ióny pomáhajú vytvárať protónový gradient a pomocou bielkovinového komplexu ATP syntázy vstupuje do štruktúry molekuly adenosintrifosfátu (ATP), ktorá je výkonným prenášačom energie v rámci bunky. Pri fotolýze vody získané elektróny vstupujú do kaskády ďalších enzymatických reakcií.
Zdroj: Lawrence Berkeley National Laboratory News Center
Diskuze:



