Genetici odhalili geny, které se podílejí na nádorovém bujení a zjistili, že široký sortiment rakovinotvorných genů ovlivňuje poměrně úzké spektrum vnitrobuněčných procesů. Podíl na vzniku nádorového bujení prokázali i u genů, které nebyly dosud s rakovinou spojovány.

Nesporný úspěch při „čtení rakoviny“ by mohl přinést zásadní zvrat do osudu projektu The Cancer Genome Atlas, který před třemi roky navrhl spustit americký genetik Eric Lander z Broad Institute v americkém Cambridge. Lander odhadoval, že přečtení dědičné informace buněk nejnebezpečnějších nádorů si vyžádá 1,5 miliardy dolarů. Skeptici však prosadili výraznou redukci ambiciózního plánu a na první testovací etapu projektu bylo uvolněno 100 miliónů dolarů. Zároveň se však odstartovaly obdobné projekty financované ze soukromých zdrojů. Nyní se ukazuje, že to nebyly vyhozené peníze.
Buňky glioblastomu mají poškozeno v průměru 60 genů. Nádory slinivky nesou obvykle 63 defektních genů. Nádory jednotlivých pacientů se spektrem poškozených genů liší. Výsledný efekt bývá ale ve většině případů podobný. Přinejmenším 70% všech zkoumaných nádorů slinivky má v buňkách narušeno asi tucet základních životních procesů.
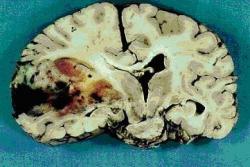
Velkým překvapením bylo pro genetiky zjištění, že se na vzniku mozkového nádoru glioblastomu podílí poškození genu IDH1. Tento defekt na jedné straně přispívá k časnějšímu nástupu onemocnění. Na druhé straně však zvyšuje dobu, po kterou pacienti chorobě vzdorují. Bez léčby umírá člověk na glioblastom obvykle do tří měsíců. Lidé se zdravým genem IDH1 dokážou při intenzivní léčbě vzdorovat glioblastomu zhruba rok. Mutace genu dovoluje pacientovi přežít s léčbou bezmála čtyři roky.
„Považovali jsme glioblastom za jednu chorobu a teď je jasné, že to jsou ve skutečnosti dvě různá nádorová onemocnění,“ říká jeden z autorů studie Victor Velculescu z baltimorského Ludwig Center for Cancer Genetics and Therapeutics.
Při léčbě glioblastomu mají lékaři k dispozici jen málo účinných prostředků. Výsledný efekt může záviset i na tom, zda má pacient poškozen gen IDH1.
Analýzy provedené týmem Lyndy Chinové z bostonského Dana-Farber Cancer Institute vrhly nové světlo na mechanismy, které obrní buňky glioblastomu vůči chemoterapii. Ukázaly, že chemoterapeutikum temozolomid zpočátku zabírá dobře na nádory, jež mají inaktivní gen zajišťující opravy poškozené DNA. Chemoterapeutikum narušuje dědičnou informaci nádorových buněk a tím je zabíjí. Zvýšený počet chyb v DNA zároveň zvyšuje pravděpodobnost vzniku genů, jež dovolí buňce opravovat defekty DNA jiným způsobem. Práce těchto genů pak „vymaže“ škody na DNA, jež jsou základem pro úspěšnou léčbu temozolomidem.
Výzkum genetických příčin nádorového bujení má obrovský význam pro diagnostiku. Mnohé nádory vypadají při vyšetření stávajícími technikami velmi podobně. Teprve jejich genetické profily prozradí, že jde o různá onemocnění, vyžadující odlišnou léčbu. Tyto poznatky otevírají cestu k cílenější a tudíž i účinnější terapii a v budoucnu i ke zcela novým lékům a léčebným postupům.
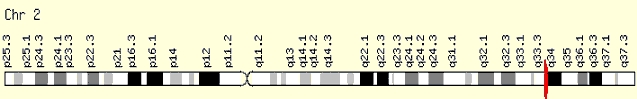
Gen IDH1 (gen pro enzym izocitrát dehydrogenázu na druhém chromozomu) ukázal, že to, co jsme u glioblastomu považovali za jeden nádor, jsou ve skutečnosti dva.ˇ (Gene Cards)
Antigeny v potravinách živočišného původu a nádory střev
Autor: Jaroslav Petr (19.09.2024)
Rakovinotvorný dětský pudr stažen z prodeje. Žel ne u nás.
Autor: Josef Pazdera (18.07.2024)
Šumavská zvěřina má pětkrát víc rakovinotvorných látek, než připouští zákon
Autor: Josef Pazdera (28.06.2024)
Personalizovaná liečba karcinómu prostaty s pomocou umelej inteligencie
Autor: Matej Čiernik (30.11.2023)
Snahy nechat rakovinu vyhladovět dostaly nový „nástroj“
Autor: Josef Pazdera (21.10.2023)
Diskuze: