
Letošní Nobelovu cenu za fyziologii a medicínu sdílejí rovným dílem Mario Capecchi z University of Utah, Martin Evans z University of Cardiff a Oliver Smithies z University of North Carolina. Ocenění se dočkali za dvacet let staré práce, jež umožnily blokovat cíleně vybrané geny v dědičné informaci myší.
„Nádherné finále celoživotní práce,“ pochvaloval si zprávu o udělení „nobelovky“ Smithies.
Odborníci dodávají, že tuto zprávu pro letos odměněné trio očekávali celá devadesátá léta a už pomalu přestávali doufat, že se Capecchi, Evans a Smithies Nobelovy ceny dočkají. Jestli tedy je na letošní Nobelově ceně za fyziologii a medicínu něco skutečně překvapivé, pak to, že nebyla udělena dříve. Ale nakonec dopadli ocenění vědci ještě dobře. Objevitel nádorových virů Peyton Rous čekal mnohem déle a Mendělejev se Nobelovy ceny nedočkal vůbec, protože mu u výboru „zasolil“ velký

Svante Arrhenius.
Každý z letošní laureátů začínal v poněkud jiném oboru, ale v osmdesátých letech se trajektorie jejich profesních osudů proťaly.
Evans studoval buňky získané z myších embryonálních karcinomů: V roce 1975 prokázal, že se tyhle buňky po vnesení do myšího embrya zabudovávají do tkání jedince, který se z takového embrya v těle náhradní matky vyvine. Takto vzniklé myši však byly náchylné k nádorům, a tak se Evans rozhlížel po jiných buňkách. Vybral si buňky myšího embrya. Kultivoval je na podkladu z jiných somatických buněk a přitom si všiml, že vytvářejí podobné kolonie jako buňky myších embryonálních karcinomů. Buňky se chovaly jako buňky embryonálního karcinomu i po vnesení do embrya. Zabudovávaly se v novém jedinci do nejrůznějších částí těla včetně pohlavních žláz, kde se podílely na tvorbě pohlavních buněk. Evans se tak stal první člověkem, kdo získal dnes tak populární embryonální kmenové buňky.

Capecchi a Smithies mezitím pracovali na vývoji metod pro cílené vnášení genů do dědičné informace savčích buněk. Capecchi zdokonalil pro tyto účely metodu homologní rekombinace vyvinutou Richardem Axelem. Brzy dokázal nahradit v buňkách funkční gen za jeho poškozenou kopii a tím vyřadit gen ze hry. Smithies v sobě nezapřel lékaře a přistoupil k celému problému z druhé strany. Zkoušel nahradit v buňkách mutované části dědičné informace nepoškozenou kopií narušeného genu. Poprvé se mu to podařilo u genu pro enzym hypoxantin-guanin fosforibosyltransferázu, jehož mutace vyvolává u člověka Lesch-Nyhanův syndrom.
V této chvíli bylo jak Capecchimu tak i Smithiesovi jasné, že pro další pokrok nutně potřebují od Evanse myší embryonální kmenové buňky. Evans nedělal drahoty.
„Přinesl mi je v kapse u saka,“ vzpomíná na klíčový moment Smithies.
Od této chvíle prováděli Smithies i Capecchi své „hrátky s geny“ na myších embryonálních kmenových buňkách. Smithies v nich opravoval poškozené geny, Capecchi geny naopak cíleně „nabourával“. Letos uplynulo dvacet let od klíčových publikací, v kterých hlásili narození myší s cíleně změněnou dědičnou informací. V roce 1989 se objevily podobné myši i v dalších laboratořích.

Vědci začali používat techniku tzv. genového knokautu k poznávání neznámých funkcí nově objevovaných genů. Genetický knokaut vyřadí z činnosti přesně určený gen. Na základě toho, co myškám s vyřazeným genem chybělo, si pak vědci vytvářejí představu, jaké funkce daný gen v těle myši plnil. Dědičné informace myši a člověka jsou si velice podobné, a tak se dá z postižení u myši usuzovat i na to, jakou roli hraje odpovídající gen v lidském organismu. A naopak. Pokud genetici zjistí, že má dědičnou chorobu člověka na svědomí „přírodní knokaut“ určitého genu, mohou si v laboratoři zcela cíleně vyrobit stejně postižené myši. Na nich pak zkoumají nejen vznik a průběh onemocnění, ale i nové metody jeho léčby.
První takový myší model lidské choroby získal Oliver Smithies. Byla to myš nesoucí stejnou mutaci, jaká u člověka vyvolává cystickou fibrózu. Následovaly další linie myší, které jsou dnes využívány např. k výzkumu vysokého krevního tlaku nebo aterosklerózy. V současnosti přesáhl počet myších modelů lidských dědičných chorob pět stovek. Počty kmenů myší s cíleně blokovanými geny jdou do tisíců. Po přečtení kompletního myšího genomu odstartoval projekt, který si klade za cíl vyblokovat postupně všechny myší geny a proniknout tak do tajů savčího genomu.
Strategie cílených zásahů do dědičné informace
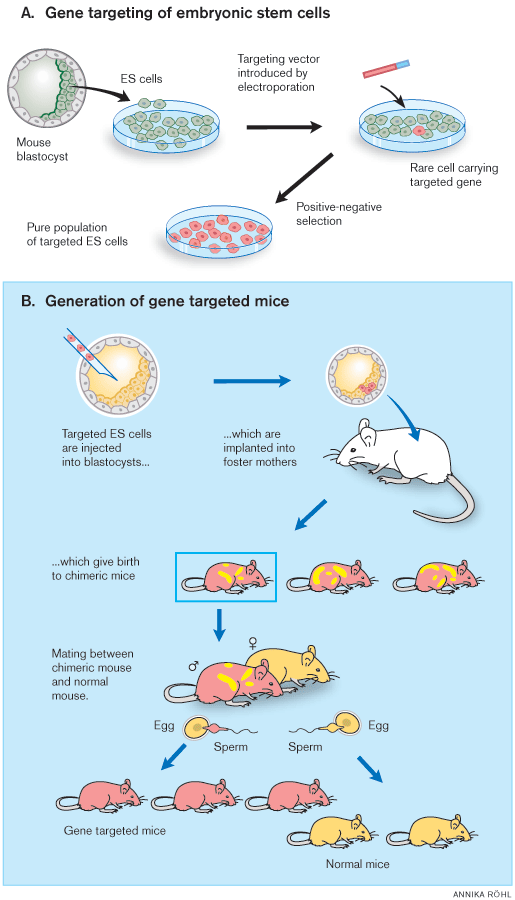
A) Po cíleném zásahu do genu embryonálních kmenových buněk (ES) v kultuře následuje selekce a namnožení buněk nesoucích žádaný zásah do DNA.
B) Tyto buňky jsou následně vstříknuty do nitra myšího zárodku a ten je přenesen do těla náhradní matky. Vznikne myš-chiméra nesoucí v těle buňky s blokovaným genem i buňky zárodku, který tyto buňky přijal. Pokud jsou buňky s blokovaným genem v pohlavní žláze a mění se na pohlavní buňky, může chiméra blokovaný gen předávat potomkům. Pro snadnější orientaci se používají pro tyto pokusy myší kmeny odlišných barev. Na schématu je jeden kmen znázorněn růžově a druhý žlutě.
Selekce buněk

Positivně-negativní selekce buněk, u kterých se podařilo zaměnit cílovou sekvenci laboratorně připraveným konstruktem. Vlevo je záměna sekvence tzv. homologní rekombinací, vpravo pak náhodná integrace genového konstruktu mimo cílovou sekvenci. Nahoře je použitý genový konstrukt, uprostřed proces zabudování konstruktu do chromozomu a dole pak výsledný stav při homologní rekombinaci (vlevo – a) a náhodné integraci (vpravo – b). Při náhodné integraci se genový konstrukt zabuduje s kazetou zajišťující rezistenci k antibiotiku (červeně) a genem pro herpes simplex virus thymidin kinázu (HVS-tk). Při homologií rekombinaci se zabuduje gen jen s kazetou pro rezistenci, protože ta je uvnitř homologních sekvencí, ale bez sekvence pro HSV-tk, která je mimo homologií sekvence. Následně se buňky ošetří nejprve antibiotikem. Tím jsou vybity buňky, které genový konstrukt vůbec nezabudovaly a jsou na antibiotikum citlivé. Poté se buňky ošetří gancyklovirem, který je v buňkách s HSV-tk přeměněn na toxický metabolit a buňky zabije. Buňky s homologií rekombinací gen pro HSV-tk nemají a gancykloviru odolají. A to jsou buňky, o které jde, protože mají cílovou sekvenci nahrazenou konstruktem.
Pramen: www.nobelprize.org, Nature, Science, The Scientist
Diskuze:



