Všichni si vzpomeneme na mimozemšťany ze sci-fi thrilleru Znamení, které bychom sklenicí vody rozhodně nepotěšili (proč si vybrali k invazi zrovna planetu pokrytou vodou ze tří čtvrtin, to bohužel ve filmu nezaznělo). Nebo třeba Vetřelce, který má místo krve kyselinu. Ve světě sci-fi zkrátka může být „životodárnou kapalinou“ kdejaká ošklivá chemikálie. Exotičtí mimozemšťané „vonící“ čpavkem nebo sírou zatím patří výhradně do říše fantazie, přesto si ukážeme, že na těchto představách by přeci jen něco mohlo být. Ale mezi námi lidmi: voda je voda...
Bez kapaliny to nejde
Kapalné rozpouštědlo je zásadní podmínkou existence života. Alespoň pokud přijmeme pojetí života jako chemického systému, používané například NASA. Jedině v kapalném prostředí se mohou složité molekuly volně pohybovat, setkávat a reagovat. Samo rozpouštědlo je také účastníkem mnoha, ba dokonce většiny metabolických reakcí.
Životodárná tekutina by měla splňovat přinejmenším následující minimum:
-
Musí být hojná, přítomná v dostatečném množství ve známých či předpokládaných prostředích. Isaac Asimov zavedl pro nejběžnější rozpouštědla termín thalassogeny (látky tvořící oceány).
-
Musí být dostatečně chemicky stabilní.
-
Musí být dostatečně fyzikálně stabilní, tedy kapalná v dostatečném rozmezí teplot. Ideálně při teplotách, které zároveň umožňují existenci složitých molekul.
-
Musí být dobrým rozpouštědlem rozmanitých molekul, včetně těch velkých a složitých.
Základní otázkou existence nebo neexistence látky v kapalném skupenství je teplota v kombinaci s tlakem. S klesajícím tlakem klesá i bod varu a s ním rozmezí kapalnosti. Proto se vám v horách vaří voda při nižších teplotách, a proto při velmi nízkém tlaku (např. na Měsíci nebo většině povrchu Marsu) kapalina existovat ani nemůže, protože se vypaří dříve, než by vůbec mohla roztát.

Polární a nepolární rozpouštědla
Znáte nejklasičtější chemický vtip? Hnědý a bílý medvěd spadli do vody. Který z nich se rozpustil a proč? No přece bílý. Protože je polární!
Pro nechemiky: rozpouštědla a molekuly obecně dělíme na polární a nepolární, podle toho, jestli (a nakolik) jsou různé části jejich molekul elektricky nabité. Například voda je rozpouštědlo polární, protože kyslík je nabitý trochu záporně a vodíky trochu kladně. Platí pravidlo svůj k svému. Polární rozpouštědlo (například voda) rozpouští polární molekuly (soli, cukry, nukleové kyseliny...). Naopak nepolárních molekul (vosky, tuky) si ani nevšimne. Tady naopak zaboduje nepolární rozpouštědlo (olej nebo ředidlo na bázi uhlovodíků).
Na tomhle principu je založena skoro celá pozemská biologie. Biomolekuly často mají polární (hydrofilní, vodu milující) a nepolární (hydrofobní, vodoodpudivé) části, a podle toho se „samy od sebe“ různě tvarují, skládají a spojují . V nepolárním rozpouštědle by to mohlo do jisté míry fungovat podobně, jenom „naruby“.
S vůní čpavku
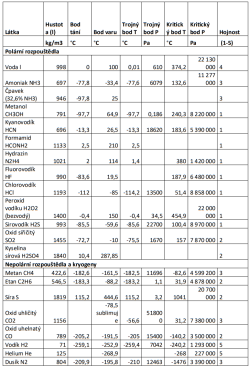
Čistý amoniak (NH3) je „u nás“ plynem, který zkapalňuje až za nízkých teplot. Také jeho výskyt je vázaný na dosti mrazivá místa, jako jsou atmosféry obřích planet, kde ho najdeme v podobě par a aerosolů, nebo ledové měsíce a trpasličí planety. Nízké teploty by znamenaly hodně „línou“ chemii i biologii.
Ačkoli pro nás lidi je amoniak zápašná, žíravá a jedovatá látka, v řadě ohledů je ze všech molekul nejpodobnější vodě. Oproti ní je však méně polární. Hydrofobní molekuly (či části molekul) se v něm proto shlukují méně ochotně, a je obtížnější v něm vytvořit například fungující obdobu buněčné membrány. Jinak jde ale o výtečné rozpouštědlo, které je slučitelné i s některými biologickými molekulami povědomého typu (alkoholy, cukry, proteiny). Taková DNA je ovšem v amoniaku nestabilní, případný život by tedy musel sáhnout po nějaké její funkční alternativě. V amoniaku funguje alternativní chemie kyselin a zásad (voda je například kyselinou).
Ve směsi s kyslíkem amoniak hoří – ať už by páchnoucí mimozemšťané dýchali cokoli, kyslík by to určitě nebyl. NH3 dále může být snadno rozbit na prvočinitele působením UV záření nebo třeba blesků. To sice platí i pro naší vodu, ovšem zatímco voda se může ze svých fragmentů snadno znovu poskládat, molekulový dusík (N2) vzniklý rozbitím amoniaku je prakticky nereaktivní, a jeho přeměna zpět na amoniak vyžaduje extrémní podmínky, které nebývají snadno k mání. Bytosti zrozené v mořích čpavku by tak časem mohly zůstat úplně na suchu.
Amoniak je neomezeně rozpustný ve vodě, vzniklý roztok označujeme jako čpavek. Protože voda je hojnější než amoniak a ráda se objevuje na stejných místech, oceán čistého amoniaku nejspíš najdeme jen stěží. Pokud zředěný čpavek mrzne, vzniká normální vodní led, který ve vzniklém roztoku plave. Může tedy vytvářet oceány pod vrstvou ledu, což jinak dovede pouze voda. Čpavek má mimochodem velmi široké rozmezí kapalnosti. Roztok obsahující ⅓ amoniaku a ⅔ vody vře při pokojové teplotě, ale mrzne až kolem -100°C. Při tak nízké teplotě ovšem nabývá konzistence hustého medu, a nějaké rozumné chemické reakce v něm budou sotva probíhat.
Pijte rychle, stmívá se!
Metanol (CH3OH) je další polární rozpouštědlo, chemicky šikovné a kapalné v docela sympatickém rozmezí teplot. Problémem je ovšem jeho relativně vzácný výskyt. Objevuje se sice v kometách nebo mezihvězdném médiu, ale nikde zatím nebyl nalezen ve větším množství nebo v kapalném stavu, nepočítáme-li tedy produkci Likérky Drak.
Exotika na uhlíkových planetách
Kyanovodík a formamid jsou skvělá polární rozpouštědla, navíc naprosto ideální pro prebiotickou syntézu složitých molekul – v tomto ohledu nechávají vodu daleko za sebou. Jenže trpí zásadním problémem: chemicky reagují s vodou (o kyslíku ani nemluvě). To je závada docela značná, protože voda je na planetách všeobecně rozšířená. Příležitost by tato rozpouštědla mohla dostat na hypotetických uhlíkových planetách. Formamid páchne úplně stejně jako čpavek. Zápach hořkých mandlí nezní tak špatně, ale čtenáři detektivek tuší, že pro nás pozemšťany ani kyanovodík nebude to pravé.
Raketová paliva a jiné chuťovky
Problémem dalších látek je jejich velká chemická nestabilita, která je předurčuje spíše do role raketových paliv nežli „thalassogenů“. Kupříkladu hydrazin (N2H2) je coby kapalné rozpouštědlo pozoruhodně blízký vodě, nicméně kromě palivových nádržích jej najdeme jen v malém množství ve stratosféře Jupiteru, navíc zmrzlý. Astrobiolog Dirk Schulze-Makuch uvažuje o Marťanech na bázi peroxidu vodíku (H2O2). Roztok peroxidu se svými rozpouštěcími vlastnostmi podobá vodě, je hygroskopický (přitahuje vzdušnou vlhkost), mrzne až při -56,5 °C a zmrznutím se nerozpíná – to všechno je v mrazivém prostředí Rudé planety velkou výhodou. V chladu ustupuje do pozadí i jeho značná chemická reaktivita, která z něj na Zemi dělá dezinfekční prostředek. Případní peroxidoví marťané by se ovšem při zvýšení teplot efektně samovznítili, což značně komplikuje jejich hledání.
Teoreticky zajímavé jsou také halogenovodíky, například chlorovodík (HCl) a fluorovodík (HF). Prakticky je problém, že halogenovodíky jsou kosmologicky vzácné a navrch extrémně reaktivní (fluorovodík ochotně leptá i sklo). Nejenže by zničily většinu představitelných komplexních molekul, ale hlavně by se samy vyčerpaly reakcemi s běžnými horninami a minerály za vzniku chloridů a fluoridů (planetu z teflonu jsme zatím neobjevili).
Provázej tě síra!
Sirovodík (H2S), vyhlášený svým zápachem po shnilých vejcích, bývá někdy vyzdvihován jako strukturní analog vody (H2O), podobně jako je křemík vydáván za možnou náhradu uhlíku. Oproti vodě má ovšem malé rozmezí kapalnosti a velmi nízkou polaritu. Na žádném známém tělese se nepředpokládá významný výskyt v kapalném skupenství. Dokonce i Venuše a Io, jinak učiněná sirná Eldoráda, obsahují sirovodík jen ve stopovém množství.
Oxid siřičitý (SO2) je v kapalném stavu velmi zajímavým rozpouštědlem, polaritou stojí někde mezi amoniakem a vodou. Jako plyn se objevuje především na Venuši (kdyby zkondenzoval, vyrovnal by se zhruba objemu pozemských jezer) a zejména na Io, kde je přítomen ve všech skupenstvích a tvoří podpovrchové kapalné rezervoáry.
Kyselina sírová (H2SO4) je silně polární rozpouštědlo s extrémně velkým teplotním rozmezím kapalnosti. Přirozeně se vyskytuje v atmosféře Venuše, a to v poměrně koncentrované podobě (70 - 98 %). Mezi pozemšťany má právem velmi špatnou pověst: Je nejenom extrémně kyselá, silně exotermicky reaguje s vodou, ale má také silně oxidující, dehydratační a/nebo sulfonační účinky na řadu organických molekul, které tak nezvratně poškozuje (např. zuhelnatění cukru). Proto je životu pozemského typu velmi nepřátelská. Výhodou je, že jako jedno z mála rozpouštědel může existovat i v kyslíkaté atmosféře. Je ovšem třeba důrazně odlišit koncentrovanou a téměř bezvodou kyselinu, jakou vidíme na Venuši, od jejích zředěných vodných roztoků, v nichž nacházíme pozemské acidofilní mikroorganismy - z našeho kosmického nadhledu totiž můžeme říci, že pořád ještě žijí ve vodě, jen maličko kyselejší. V koncentrované kyselině sírové nejsou pozemské biomolekuly vůbec stabilní a o životě „našeho typu“ tam nemůže být řeči. Sice tam může existovat složitá organická chemie, ale docela jiná, než s jakou máme běžně zkušenost. Zda by tam mohly vznikat například membrány nebo molekuly nesoucí dědičnou informaci zatím není vůbec jasné. Zajímavé je, že i v takto agresivním kapalném prostředí probíhá přirozená syntéza organických molekul z oxidu uhelnatého. Kyselina sírová v podobě oceánu by reagovala s horninami a minerály za vzniku síranů, čímž by se časem vyčerpala (zneutralizovala). To se ovšem netýká Venuše, kde je hlavní rezervoár kyseliny atmosférický a s podložím vůbec nepřichází do kontaktu.
Nepolární rozpouštědla
Svými vlastnostmi se nepolární kapaliny blíží olejům a ředidlům spíše než vodě. Nejběžnější budou uhlovodíky ze skupiny alkanů, které ze známých prostředí najdeme hlavně na Titanu. Metan sice musíme zařadit spíše ke kryogenům, ale vyšší uhlovodíky už mají mnohem zajímavější rozmezí kapalnosti. Protože v uhlovodíku nedochází k hydrolýze, byly by organické molekuly velmi stabilní, a prebiotická syntéza by byla snadnější. Jako možné biomolekuly pro uhlovodíková moře byly navržené polylipidy, polyétery by mohly plnit úlohu nositelů dědičnosti, a roli buněčných membrán by zastávaly molekuly odvozené od akrylonitrilu, tvořící měchýřky zvané azotozómy, i když není jasné, nakolik by byly stabilní. Uhlovodík je poněkud paradoxně kompatibilní i s chemií na bázi křemíku (silany a jejich deriváty). Že se uhlovodíky nemají míchat s kyslíkem, je známá věc, která platí ve vesmíru stejně jako na Zemi. Je ovšem zajímavé, že v atmosféře bohaté na uhlovodíky (např. na Titanu) vznikají fotochemické produkty (“smog”) které pohlcují UV záření a mohou suplovat ozónovou vrstvu i v prostředí bez kyslíku.
Velmi specifickou vysokoteplotní kapalinou je elementární síra, známá z Jupiterova satelitu Io. Nám evokuje spíše peklo, nicméně taje už při 115°C, takže by mohla být slučitelná i s biochemií na bázi organických látek (pozemská biochemie funguje až do 121°C, takže se s rozmezím kapalnosti síry mírně překrývá). Specifikem síry je, že při teplotách nad 155°C polymeruje a její viskozita tudíž s teplotou rapidně roste. Život na bázi síry by se tedy musel vejít do poměrně úzkého teplotního okna, kdy je síra již kapalná, ale její viskozita ještě není neúnosně vysoká. Viskozita síry nicméně může být snížena příměsemi sirovodíku, organických sloučenin aj., čehož se využívá v průmyslu, a mimozemská biologie by si s tím nepochybně také nějak poradila.
Kryogeny
Ke kryogenním rozpouštědlům můžeme počítat tekutý dusík, vodík a hélium, oxid uhelnatý a uhličitý, a z uhlovodíků metan a etan. Jsou to všechno malé, nepolární molekuly, které kondenzují jen za velmi nízkých teplot a/nebo vysokých tlaků. Jejich předností (možná jedinou) je velmi hojný výskyt – vodík a hélium jsou nejhojnější prvky vůbec, dusík a oxid uhelnatý se vyskytují ve formě ledu na transneptunických tělesech a Tritonu. Chemické reakce organických molekul za kryo-teplot prakticky neprobíhají. Život na bázi kryogenů by tudíž musel být biochemicky exotický, např. na bázi křemíku (silany), nebo využívat jiné druhy interakcí, než je klasická chemie kovalentních vazeb (slabé vazebné interakce nebo radikálová chemie). Hlavním problémem všech kryogenů je ovšem velmi nízká rozpustnost molekul (prakticky jakýchkoli a velkých obzvlášť) za velmi nízkých teplot, která život na jejich bázi dost možná zcela vylučuje.
Za vysokých tlaků můžeme „kryogeny“ najít i při docela zajímavých teplotách a hustotách v tzv. nadkritickém stavu, kdy mají stále některé vlastnosti kapaliny a mohou fungovat jako rozpouštědla. Například v určitých vrstvách Saturnu, Uranu a Neptunu existuje nadkritický vodík při teplotách slučitelných s chemií na bázi uhlíku. Nadkritický CO2 se zase používá jako rozpouštědlo v průmyslu a potravinářství (např. při chemickém čištění či výrobě bezkofeinové kávy). Z hlediska mimozemské biochemie však tato prostředí dosud příliš studována nebyla.
Voda základ života
Často si myslíme, že voda je něčím vzácným, co odlišuje naší planetu od zbytku vesmíru, nebo aspoň Sluneční soustavy. Pokud ale dohlédneme dál než na Měsíc nebo Venuši, zjistíme pravý opak. Vody je všude plno! A není se co divit. Voda je sloučeninou v kosmu nejhojnějšího prvku (vodíku) s třetím nejhojnějším (kyslíkem). Druhé v pořadí je helium, a to žádné sloučeniny netvoří. Žádná jiná látka (s výjimkou vodíku a hélia) se s vodou nemůže co do množství ani zdaleka měřit, i poměrně běžný amoniak za ní zaostává zhruba o řád. Jistě, ne všude může být tato voda přítomná i v kapalném skupenství, ale tentýž problém bude mít i jakákoli jiná látka.
Nikoho nepřekvapí, že voda je výborné rozpouštědlo. Díky vodíkovým můstkům má i neobyčejně široké rozmezí kapalnosti při biologicky zajímavých teplotách. Voda se při zmrznutí rozpíná, vodní led plave. Tato výjimečná vlastnost je ovšem pro biologické rozpouštědlo zároveň prokletím i požehnáním. Rozpínání mrznoucí vody doslova trhá buňky, což je pro většinu organismů bez speciálních přizpůsobení smrtelné. Na druhé straně plovoucí led izoluje kapalinu pod sebou a účinně brání dalšímu zmrznutí, proto řeky, jezera a moře zřídkakdy promrznou až na dno – vodní organismy se tak mohou nebezpečí zmrznutí často velmi jednoduše vyhnout.
Voda je lehká a křehká molekula. Nízká molekulová hmotnost ji předurčuje ke snadnému úniku z planetárních atmosfér (tím spíše, pokud je fotolyzována UV paprsky na vodík a kyslík). Klimatologicky je voda doslova noční můrou: Když zamrzne, je bílá a odráží sluneční světlo (čímž nahrává dalšímu ochlazení), naopak když roztaje, je tmavá a sluneční světlo pohlcuje (čímž nahrává oteplení). Vodní pára je skleníkový plyn, který ohřívá planetu, přičemž každé oteplení uvolní do atmosféry ještě více vodní páry! Voda má zkrátka tendenci strhávat planetární klima směrem k extrémům, a je zajisté dobře, že v pozemském klimatu hrají roli i jiné faktory než jen působení vody, jinak by naše planeta dávno nebyla ani modrá, ani zelená.
Dalším specifikem vody je její vysoká chemická reaktivita. V planetárním měřítku čelí podobnému problému, který jsme zmiňovali třeba u fluorovodíku – chemicky reaguje s horninami a minerály, často docela bouřlivě (hydratace, serpentinizace). Voda ovšem (na rozdíl od fluorovodíku) má dobrou šanci pomyslnou bitvu vyhrát, protože je jednoduše v přesile.
Co je ještě horší, voda agresivně napadá (hydrolyzuje) mnohé chemické vazby, což je nemalý problém pro prebiotickou chemii a biochemii. Dokonce i naše nejmilovanější biomolekuly (včetně samotné DNA nebo proteinů) jsou vodou poškozovány, a organismy je musejí pravidelně nahrazovat či opravovat. S nadsázkou lze říci, že voda je takový chemický „prevít“, že ani po čtyřech miliardách let jsme si na ni tak úplně nezvykli. Všichni (a netýká se to zdaleka jen medvědů) se vlastně ve vodě velmi pomalu rozpouštíme. V tomto světle musíme chápat i stále sílící mezinárodní hnutí usilující o úplný zákaz DHMO.
A na to se napijme!
I když se pokusíme kompenzovat všechna naše geocentrická a antropocentrická zkreslení, jeví se voda jako nejpravděpodobnější volba pro biologické rozpouštědlo. Není to ani tak proto, že by byla ve svých rozpouštěcích, chemických a termodynamických vlastnostech nějak mysteriózně zázračná, jak se někdy tvrdí. Voda, jak jsme si řekli, má i docela podstatné nevýhody, a to, že se s nimi život úspěšně popasoval a dokonce je využil ve svůj prospěch, svědčí spíše o vynalézavosti evoluce než „dokonalosti“ vody. Voda nicméně naše pomyslné „výběrové řízení“ na životodárnou kapalinu na celé čáře vyhrává tak říkajíc hrubou silou, protože jí je nejvíc.
Pokud se tedy na naší obloze objeví létající talíře, můžeme si s poměrně slušnou jistotou vsadit, že nabídnutou sklenicí vody hosty neurazíme. Mimozemské bytosti na bázi jiných kapalin, i kdyby jejich vzniku nebránily žádné principiální důvody (o čemž zatím nevíme), budou nejspíše podstatně vzácnější.
Poznámka redakce
Pokud máte rádi exotické mimozemšťany a chtěli byste se s nimi blíže seznámit, autorovi tohoto článku právě vyšel román Azhareida.
|
Končí jedenatřicáté století a pro kolonisty z hvězdné soustavy Efesuma je Země jen zpola zapomenutou vzpomínkou. Hlad po surovinách přivádí potomky pozemšťanů i na ledový měsíc Megan, zahalený oblaky mrazivé, smrtelně jedovaté mlhy... (odkaz)
|
Pod záštitou Evropského Astrobiologického Institutu nedávno vyšla sbírka sci-fi povídek specificky věnovaná exotickým formám života, nazvaná Life Beyond Us, již spolueditovala Julie Nováková a vedle zvučných jmen světové sci-fi do ní autorsky přispěl také autor tohoto článku. (odkaz)
|
Odkazy
Dirk Schulze-Makuch, Louis Neal Irwin Life in the Universe: Expectations And Constraints
Benner, S. A., Ricardo, A., & Carrigan, M. A. (2004). Is there a common chemical model for life in the universe?. Current opinion in chemical biology, 8(6), 672-689.
Schulze-Makuch, D., & Irwin, L. N. (2006). The prospect of alien life in exotic forms on other worlds. Naturwissenschaften, 93(4), 155-172.
http://www.xenology.info/Xeno/8.2.2.htm
https://www.daviddarling.info/encyclopedia/A/ammonialife.html
https://en.wikipedia.org/wiki/Hypothetical_types_of_biochemistry
V rámci klasické science fiction vytěžil téma exotických mimozemšťanů na bázi všech možných i nemožných rozpouštědel a biochemií především Hal Clement, a poněkud humorně tuto problematiku pojali Strugačtí ve své pohádkově laděné Výpravě do pekla.
Diskuze:
Čo naliať mimozemšťanovi ...
Vladimír Bzdušek,2023-03-13 09:42:23
Čo naliať mimozemšťanovi ...
No problem. Štyria z piatich opilcov doporučuje rum.
Ale inak.
Voda je v článku porovnávaná ako rozpúšťadlo.
Ale má aj iné funkcie, napr. pri vytváraní organických biopolymérov.
Tu by bolo porovnanie ťažšie ...
Re: Čo naliať mimozemšťanovi ...
Tomáš Petrásek,2023-03-13 17:33:36
Právě že ta role vody při tvorbě polymerů je obojaká - aby se spojily dvě jednotky (např. aminokyseliny do peptidu) musí se uvolnit molekula vody. Protože ovšem je voda v nadbytku, daleko snáze se stane opak: voda se vmezeří do peptidové vazby a hydrolyzuje ji. V případě zejména formamidu se vyzdvihuje, že tam polymery vznikají spontánně a nerozpadají se. Alespoň na první pohled by se zdálo, že je to pro vznik života mnohem lepší situace. Je ale možné, že v takovém prostředí by se syntéza polymerů v organismu hůře regulovala nebo by to mělo jiné nevýhody, které "od stolu" nevidíme.
Rozhodně nezpochybňuju, že voda je pro náš metabolismus tou nejzákladnější surovinou, sotva se dá vymyslet reakce, kam by aktivně nevstupovala.
Pepa Nováků,2023-03-13 09:14:21
Když bych si měl vsadit, tak mimozemské stvoření schopné doletět na Zemi si představuju tak, že zdvořile požádá o dočerpání antihmoty, nebo alespoň nějakých izotopů na fůzi, případně budou hledat elektrickou zásuvku.
Re:
Tomáš Petrásek,2023-03-13 17:24:33
Jasně, Von Neumannova sonda nebo něco na ten způsob. Definice života dle NASA tam má zahrnuté, že život musí být chemický systém, takže umělé inteligence (ať už na bázi elektronek nebo mikročipů) se automaticky diskvalifikují. Ale co se mě týče, byl bych ochotný to za život uznat, jakmile se to samostatně rozmnožuje a vyvíjí.
tepelná kapacita vody
Martin Smatana,2023-03-13 08:47:42
Autor píše o vplyve vody na klímu z hľadiska odrazivosti ľadu alebo pohlcovania tepla kvapalnou vodou. V tomto má obrovský vplyv tepelná kapacita vody, alebo inak aj merné teplo. Voda potrebuje pohltiť veľké množstvo tepla, aby sa jej teplota zdvihla o 1°C alebo o 1 K. To má významný stabilizujúci vplyv na klímu, porovnajme oceánsku a kontinentálnu klímu - kde sú väčšie výkyvy teplôt počas roka alebo dňa. Neviem, či sa niektorá z autorom vymenovaných chemikálií môže porovnávať s vodou. Ešte aj šamot používaný v peciach a akumulačných kachliach má len 20% tepelnej kapacity vody, má ale výhodu, že sa pri zahriatí neodparuje.
P.S. a čo tak život založený na ortuti ako rozpúšťadle? :)
Re: tepelná kapacita vody
D@1imi1 Hrušk@,2023-03-13 11:34:26
Jste si jistý, že ten stabilizující vliv je způsobený měrnou tepelnou kapacitou spíše než tekutostí? Běžná hornina žádnou výjimečnou tepelnou kapacitu nemá ale pár metrů pod povrchem je teplota celoročně neměnná, přitom na povrchu kolísá o desítky stupňů i v rámci jediného dne. A když nechám stát PETku s vodou na povětrnosti, bude její teplota kolísat víceméně stejně jako okolní kamení a vyšší měrná tepelná kapacita vody to nevytrhne. Naopak tam, kde se vyskytují ventaroly, vzniká celoročně velmi stabilní mikroklima. To, co rozhoduje, je, že vzduch může přijít do styku s mnohem větší masou horniny/vody. U oceánu díky tomu, že se voda u hladiny promíchává se spodními vrstvami, u ventarol díky systému puklin.
Re: Re: tepelná kapacita vody
Martin Smatana,2023-03-13 15:25:27
Súhlasím s Vami, pán kolega, ide aj o možnosti vedenia tepla. Ďalším faktorom sú masy vody na Zemi, doslova tisíce kilometrov kubických, ktoré už nejakú tú kapacitu majú, určite väčšiu ako PETka.
No a pokiaľ viem, v hĺbke približne 10 m pod povrchom je teplota pôdy približne rovnaká ako je priemerná teplota ovzdušia, v závislosti od druhu a typu pôdy, pôda je celkom dobrý tepelný izolátor.
Slovo "ventarola" som si musel vyhľadať, ale dobre som tipoval, že to súvisí s vetrom (napríklad po španielsky "viento").
Re: Re: Re: tepelná kapacita vody
Tomáš Petrásek,2023-03-13 17:18:05
Vyšší tepelná kapacita je určitě lepší. V tomhle ohledu se s vodou může velmi úspěšně měřit amoniak (voda 4180 J/(kg*K), amoniak 4601 J/(kg*K)). U ostatních kapalin, kde jsem relevantní hodnoty našel, je výrazně nižší (typicky tak 2x). Ale jak psali předchozí diskutující, není to jediný faktor. Taky si lze představit řadu prostředí, kde tepelná kapacita nehraje velkou roli (třeba ve velmi husté atmosféře nebo podzemí).
křemík
Tomáš Petrásek,2023-03-13 01:10:36
Já bych tomu křemíku moc šancí nedával ani v amoniaku, protože v amoniaku je většinou i voda, a tu křemík opravdu nerad. Šanci by měl v kryogenech (metan, dusík, vodík...), jenže tam se mizerně rozpouštějí i křemíkové molekuly. Moc dalších uvěřitelných alternativ není
Vsadil bych se, že život bude téměř vždy založený na stejné stavebnici C H O N S P jako ten náš, "jenom" se bude lišit, co se z ní poskládá, případně jaké vzácnější prvky se přiberou do hry. I tak je těch možných sloučenin skoro neomezené množství.
Přednášky
Petr Jíčínský,2023-03-12 20:22:49
Přednášky pana Petráska na youtube jsou velmi zajímavé, léta je sleduji. Ale zde se podle mě zbytečně probírají nesmyslné alternativy. Otázka je položena dle mého špatně (jak by řekl prof. Klaus :-), vše se odvíjí od toho, na jakém prvku je založen život, pak můžeme konstruovat. Dle hojnosti zastoupení ve vesmíru a tedy pravděpodobnosti vzniku a vlastností vazeb je to jednoznačně uhlíková organická chemie a polární voda. Starou, a nevím, jak dnes populární, je alternativa s křemíkem a polárním amoniakem. Víc při pohledu na periodickou tabulku prvků nevidím.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce