Sirovodík čili sulfan se dvěma vodíky a jednou sírou si nespletete. Smrdí jako čert, tedy jako zkažené vejce. Je to problematická sloučenina, počínaje tím, že je prudce jedovatá. Vyskytuje se například v sopečných plynech, ale často se s ním lze setkat i v civilizaci. Hojně se objevuje ve stokách, různých skladištích nebo skládkách. Obzvláště nepříjemný je jako vedlejší produkt v petrochemickém průmyslu nebo třeba při výrobě bioplynu, přičemž je často nutné sirovodík komplikovaně odstraňovat.
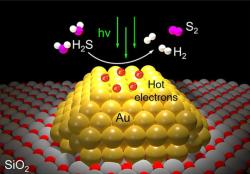
Co kdybychom ale tenhle smradlavý problém proměnili ve výdělečný podnik? Přesně o to se svými kolegy usiluje Naomi Halasová z americké Rice University. Vyvinuli technologii založenou na nanočásticích zlata, se kterou je možné přeměnit sirovodík na ceněný vodík a síru. Tato přeměna probíhá v jediném kroku. Ještě lepší je, že veškerou energii pro tuto reakci poskytuje světlo, tedy například sluneční záření, ale i jiné zdroje.
Jak říká Halasová, emise sirovodíku komplikují průmyslu život, ale jeho likvidace stávajícími postupy je velmi nákladná. Jejich nanofotonický tým přichází s převratným a komerčně životaschopným nanokatalyzátorem. Jde o plazmonickou fotokatalýzu, která by mohla být mnohem levnější než soudobé postupy pro likvidaci nežádoucího sirovodíku.
Badatelé vyrobili nanokatalyzátor tak, že pokryli povrch zrn oxidu křemičitého nanočásticemi zlata. Každá z těchto nanočástic intenzivně reaguje se specifickou vlnovou délkou viditelného světla. Tyto plazmonické reakce vytvářejí vysokoenergetické a krátkověké elektrony („hot carriers“), které pohánějí fotokatalýzu.
Halasová s kolegy názorně předvedli v laboratorních experimentech, že tuto fotokatalýzu je možné provést i se soustavou LEDek. Katalyzátor prostě přeměňuje sirovodík na plynný vodík a síru. Je to velmi křiklavý kontrast k dnešnímu zpracovávání sirovodíku, které se typicky spoléhá na Clausův proces. Ten má snad všechny nevýhody, co člověka napadnou. Jde o spalování sirovodíku na oxid siřičitý a následnou katalytickou reakcí oxidu siřičitého se zbylým sirovodíkem. Proces vyžaduje řadu různých kroků a teploty až kolem 815 °C. Je to nákladné a asi nejhorší je, že nevzniká vodík. Produktem Clausova procesu je síra s vodou.
Na uplatnění plazmonické fotokatalýzy sirovodíku již pracuje startup Syzygy Plasmonics z Houstonu, u jehož zrodu stála i Halasová. Se svými kolegy věří, že jejich metoda může být natolik levná a účinná, že ji bude možné využít pro likvidaci sirovodíku i ze zdrojů mimo průmysl, jako například z kanalizačního plynu anebo živočišné výroby. Zároveň bude možné k rozkladu sirovodíku používat LEDky nebo ještě „zelenější“ solární elektřinu.
Video: Naomi Halas: From Faraday to tomorrow: nanoscale optics for sustainability and societal impact
Literatura
Reprodukce bez sulfanu je jako život bez reprodukce
Autor: Jan Nevoral (01.07.2014)
Katalyzátor z nanomědi recykluje oxid uhličitý na ethen
Autor: Stanislav Mihulka (18.01.2018)
Věčný zdroj čistého vodíku: odpadní voda s exkrementy
Autor: Stanislav Mihulka (16.09.2020)
Splněný sen: Nový katalyzátor dělá z metanu metanol za pokojové teploty
Autor: Stanislav Mihulka (01.07.2022)
Diskuze:
Co kdybychom ale tenhle smradlavý problém proměnili ve výdělečný podnik?. Přesně o to se svými kolegy usiluje Naomi Halasová z americké Rice University.
Josef Hrncirik,2022-11-08 11:35:58
240 let šlechtění australští trestanci vyvinuli technologii založenou na nanočásticích zlata, se kterou je možné přeměnit sirovodík na ceněný vodík a síru. Tato přeměna probíhá v jediném kroku. Ještě lepší je, že veškerou energii pro tuto reakci poskytuje neodolatelný třpyt zlata, tedy například sluneční záření, ale i jiné zdroje.
Jak říká Halasová, emise sirovodíku komplikují průmyslu život, ale jeho likvidace stávajícími postupy je velmi nákladná. Jejich nanofotonický tým přichází s převratným a komerčně životaschopným nanokatalyzátorem, ryzím zlatem. Jde o plazmonickou fotokatalýzu, která by mohla být mnohem levnější než soudobé postupy pro likvidaci nežádoucího sirovodíku.
Bádatelé vyrobili nánokatalyzátor tak, že pokryli povrch zrn oxidu křemičitého nánočásticemi zlata. Každá z těchto nánočástic intenzivně reaguje se specifickou vlnovou délkou 525 nm viditelného světla. Plazmonické chem. reakce vytvářejí vysokoenergetické a krátkověké elektrony („hot carriers“), které pohánějí fotokatalýzu. (zázračný spor s definicí katalyzátoru)
Halasová s kolegy názorně předvedli v laboratorních experimentech, že tuto fotokatalýzu je možné provést i se soustavou LEDek. Katalyzátor (božstvo zlato) prostě zázračně proměňuje sirovodík na plynný vodík a pekelnou síru.
Jediný problém, pochopitelně zcela zamlčený je, že to i při zcela nepoužitelně nízké konverzi 2/3 při 1 kontaktu s extrémně třpytícím se zlatem vyžaduje 2 fotony na H2S/1,8% kvant. účinnost *100/67% konverze*2,36e.V fotonu max. kv. úč./0,087 V pro rozklad H2S na H2*1,21 V pro rozklad H2O taktéž na prvky st. stavu = 5290x více energie než je teoreticky nutno dodat na rozklad H2S, či min. 380x více energie než je možno z uvolněného H2 získat.
Vodík ze směsi zakoncentrovat (vyčistit vyžaduje další energii, nemluvě o nezbytnosti odstranit zbylých nezreagovaných 33% velmi škodlivého H2S).
Je to velmi křiklavý kontrast k dnešnímu zpracovávání sirovodíku, které se typicky spoléhá na Clausův proces. Ten má snad všechny nevýhody, co člověka napadnou. Jde o spalování sirovodíku na oxid siřičitý a následnou katalytickou reakcí oxidu siřičitého se zbylým sirovodíkem. Proces vyžaduje řadu různých kroků a teploty až kolem 815 °C. Je to nákladné a asi nejhorší je, že nevzniká vodík. Produktem Clausova procesu je síra s vodou. Konverze min. 95-99,5% a získává se cca 2x více vysokotlaké páry než síry.
Že se spálí H2 z H2S nevadí; k dispozici je procesní teplo 800°C a pára pro jeho výrobu reformací uhlovodíků. Am. J. Environ. Sci., 4 (5): 502-511, 2008
Na uplatnění plazmonické fotokatalýzy sirovodíku již pracuje startup Syzygy Plasmonics z Houstonu, u jehož zrodu stála i Halasová. Se svými kolegy věří, že jejich metoda může být natolik levná a účinná, že ji bude možné využít pro likvidaci sirovodíku i ze zdrojů mimo průmysl, jako například z kanalizačního plynu anebo živočišné výroby. Zároveň bude možné k rozkladu sirovodíku používat LEDky nebo ještě „zelenější“ solární elektřinu.
Na 10.ř. článku kanálníci píší, že Velký Satan emituje z k análů cca 9800 t H2S/y in US alone, a tamtéž průmysl Clausovým procesem po rafinacích získá cca 2 Mt síry.
Re: Aby se v tom prasoklokan (čert tasmánský) vyznal.
Josef Hrncirik,2022-11-08 22:00:49
Teprve v suplementech čl. ACS Energy Letters 7: 3666–3674. na s. S18 je psáno, že veškerá měření byla provedena jen na 5 mg katalyzátoru válcové vrstvičky průměru 2 mm výšky též 2 mm, dopadové plochy světla 3,14 mm2. Tímto ložem vždy protékalo 20 sccm (stand. cm3/min) plynných směsí H2S + Ar. Formální rychlost průtoku volným ložem tedy byla cca 10,6 cm/s. Při teplotě 300-500°C a neuvedené tlakové ztrátě a pórovitosti řekněme 0,5 mohla být až 4x větší, tj. zdržná doba jen cca 2 mm/(400 mm/s) jen cca 5 ms. Jaká je hloubka průniku světla či tepla (skutečná aktivní vrstva neuvedeno). Měření s jinou výškou vrstvy či průtoky neprovedeno. Ozáření lože a jeho produkce byly formálně přepočítány na 1 cm2 a 1 g katalyzátoru z reálných 3,14 mm2 do 5 mg kat. se 2% hm. zlata. Produkce byla též přepočítána z umol H2/(g kat.s) na vzniké atomy H na každém atomu Au/s tzv. TOF (frekvence přeměny). Byla vyjádřena též formální vnější kvantové účinnost fotoreakce (EQY) jako počet atomů H uvolněných /1 foton vzářený do reaktoru. Na H2 jsou při elektrolýze spotřebovány při redukci 2 e- a při jednotkové kv. účinnosti (EQY) 2 fotony potřebné vlnové délky. Kv. účinnost byla nejlepší při světle 525 nm, poloviční při cca 460 či 560; čtvrtinová při 590 nm a asi i bílém světle, viz TOF fig.2 s 3668 čl.
Kdo jak a komu řekl budiž 410 mW světla pásma 525 +-25 nm v ploše pí mm2 se nepodařilo ani FBI z otrlých australských zločinců vytlouci. Rozplést spiknutí pak bylo jednoduché. Pod 1 cm2 bylo 159 mg kat s 3,18 mg 24 kar. Au, tj. 16,2 umol Au. Při optimu 10 W/cm2 byl TOF 0,2/s, tj. produkce H atomů 3,23 umol/s ergo kla dívko H2 jen 1,61 umol/s. 10 Ws oslnivého třpytu zlata je pouhých 10 Joule. Při 525 nm Planck ručí 2,36 e.V/foton, tj. půjčí 10/2,36 V/96500 = 43,9 umol fotonů ergo kla dívko 21,9 umol H2 při 100% vnější (celkové) kv. účinnosti (EQY=1).
Potom je ale účinnost 1,61/21,9 = 7,4%.
Proč jsou trestanci tak skromní a hlásají max. EQY jen 1,8% s. 3667, 4. ř. odspodu?
Protože 75 % zlata jim zůstalo za nehty, nebo stejně jako peer to peer revieuwrs neumí počítat.
Hlavní problém se sírou je její de-polymerace z krystalické S8 přes S7 ev. S6 na dimer S2, podle teploty, tlaku a kinetiky. Disociace je silně endotermní a s tlakovou závislostí reakcí ovlivňuje polohu rovnováhy. Síra ev. kondenzující na ev. katalyzátoru brzdí jeho účinek.
Tlak par síry a výparné teplo v závislosti na teplotě je v /10.1021/j150306a002 . CLAUS PROCESS je složitý problém např. CLAUS PROCESS CALCULATED CHEMICAL REACTION EQUILIBRIUM FOR THE Thesis-1978D-M111c.pdf (shareok.org); či American Journal of Environmental Sciences 4 (5): 502-511, 2008
Průmyslový pochod vyžaduje zakoncentrování H2S ? nad 15% a odstranění CO2 ev. uhlovodíků a přesné dávkování O2. Účelem je minimalizace H2S, SO2, ev. COS v koncovém plynu. K tomu vede nejlépe jen oxidace H2S na H2O a pokud možno S jako S8.
Prostě jak sprostě říká Séreš: “Nesér se s laséry, prostě spal vodík, nebo Ti ne půjčím a snížím nízký rating do zá porna. Takový je pekelný puch financí na sekyru proti embargu!“
Co to takhle skusit s jinými kysličníky,
Karel Ralský,2022-11-05 12:57:36
někdy mám jako laik pocit že katalýza je skrytá atomární reakce(studená fůze). A vedlejší produkt záření alfa je překryt mnohonásobně "přirozenou radiací".
a co SO2 na H2SO4 ?
Florian Stanislav,2022-11-04 19:41:31
Článek píše :"Jde o spalování sirovodíku na oxid siřičitý a následnou katalytickou reakcí oxidu siřičitého se zbylým sirovodíkem.."
No, oxid siřičitý je mezistupeň výroby kyseliny sírové, takže logické se zdá v místě, kde je velký odpad sirovodíku postavit výrobu H2SO4. Redukovat SO2 na síru a pak oxidovat na SO2 snad může mít význam z hlediska snazší dopravy.
Re: a co SO2 na H2SO4 ?
Petr Galipoli,2022-11-05 08:14:00
Také mě to napadlo. To s tou výrobou kys. sírové. Je otázka, zda se vyplatí vybudovat nový provoz a nevyužívat ten stávající, a vzniklou síru tam jen dovážet. Zejména když po útlumu tepelných elektráren přijdou o levný zdroj oxidu siřičitého.
Poznámka
Petr Galipoli,2022-11-04 11:09:24
Věta: „Zároveň bude možné k rozkladu sirovodíku používat LEDky nebo ještě „zelenější“ solární elektřinu." je poněkud nešťastně formulována (aspoň dle mého názoru). LEDky jsou jen zdroj světla. Zda k jejich napájení bude použito elektřiny z uhelných/jaderných/plynových/OZE je věc jiná.
Re: Poznámka
Josef Hrncirik,2022-11-09 08:44:11
Básník chtěl latentně říci, že k výrobě zeleného vodíku bude použito čistě zelené světlo 525 nm vyfiltrované jako odpad ve sklenících s konopím. Dále chtěl básník praviti, že už nikdy nebude míchat rum, gin a konopí a červené Lu Cerny Molin Rouge.
10W el. LED 525 nm má opt. výkon jen 1 W, tj. ú činnost jen 10%.
Australští trestanci zapomněli, že kdyby H2 místo fotolýzou H2S vyráběli elektrolýzou vody, vyrobí ho stejnou energií minimálně 10x více a při kvantové ú činnosti připusťme i 2% cca 500 x více. Pokud se štěpí nepevný H2S a nikoliv H2O , bude to 5000x.
Re: Re: Poznámka
Josef Hrncirik,2022-11-09 09:59:01
Rómští čórkaři Mukesh Kumar and Tharamani C. Nagaiah již publikovali placený čl.
Efficient production of hydrogen from H2S via electrolysis using CoFeS2 catalyst.
Rozpustili H2S v 1M NaOH na NaHS, který při elektrolýze poskytl H2 při cca 5x nižším napětí než elektrolýzou NaOH. Vznikající síra na anodě však elektrolýzu okamžitě zastavila (izolant) a musela být rozpouštěna jako polysulfid. Z něj uvolnit S8 je energeticky a technologicky náročnějšé než jen elektrolyzovat vodu.
Břídilové bez zlata.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce