Dožít se vyššího věku ve zdraví, je velkou výhrou. Můžeme sice pro to sami hodně udělat zdravým životním stylem, ale i tak nemusíme mít štěstí. S přibývajícími léty roste riziko tělesných neduhů a duševních poruch, obvykle spojených s nějakou formou demence, statisticky nejčastěji s Alzheimerovou nemocí. Je těžkým údělem nejen pro samotného pacienta, ale i pro jeho blízkou rodinu. A velkou zátěží pro zdravotní systém. V České republice, kde touto nemocí trpí kolem 160 tisíc lidí, přesáhl v roce 2020 počet nově diagnostikovaných případů číslo 68 tisíc, což je téměř dvojnásobek počtu z roku 2010. Léčba, která je vlastně jen soubojem s příznaky a rychlostí, jakou neurodegenerativní choroba okrádá člověka doslova o jeho „Já“, stojí ročně pojišťovny asi dvě miliardy korun. Jak tuto situaci ovlivní neodvratný růst všech nákladů, raději ani nedomýšlet.
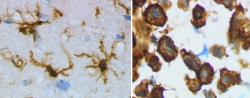
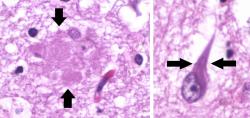
Alzheimerova nemoc je vážným celospolečenským problémem a velkou výzvou pro vědce. Přes dlouhou historii rozsáhlého výzkumu není vše zodpovězeno a do mozaiky možných příčin a důsledků přibývají nové důležité dílky. Jedním z nich je studie, kterou 20. dubna zveřejnil časopis Journal of Biological Chemistry, Tým vědců ze tří prestižních amerických univerzit – Johns Hopkins University, University of Georgia, State University of New York – v něm popisuje zajímavý objev, který může výrazně přispět ke včasné diagnostice, ke zdokonalení léčby a možná po dalším výzkumu i k tomu nejnadějnějšímu – k prevenci. Již dávno se ví, že v mozku pacienta s „Alzheimerem“ nervové buňky odumírají v důsledku nahromadění chybně prostorově poskládaných proteinů vytvářejících extracelulární amyloidní plaky a také v důsledku intracelulárních shluků jinak velmi důležitého proteinu tau, z něhož ale nežádoucí hyperfosforylace (nadměrné množství fosforylovaných aminokyselin v molekule) vytváří škodlivé nerozpustné slepující neurofibrilární vlákna a klubka. Náš imunitní systém má důmyslnou obranu vybudovanou i proti takovým rizikovým zašmodrchancům. Něco lehce přes deset procent všech buněk v centrálním nervovém systému tvoří mikroglie – speciální makrofágové buňky, jež „požírají“ infekční patogeny i poškozené proteiny, odstraňují nefunkční nervové buňky. Působí tedy jako uklízeči. Mezi povrchové struktury těchto mikroglií patří i transmembránové receptory CD33, označované také Siglec-3. Již nějaký ten rok se o nich ví, že v mozcích postižených Alzheimerovou degenerativní nemocí jsou nadmíru aktivní, čímž tlumí fagocytózu, tedy pohlcování škodlivých částic mikrogliemi. A také je známé, že spouštěčem aktivity receptoru CD33 je molekula skládající se z polysacharidové složky (glykanu) a bílkoviny (proteinu), tedy glykoprotein. Přesněji sialoglykoprotein, protože součástí „cukerné“ složky molekuly je i zbytek kyseliny sialové. Právě touto částí se sialoglykoprotein na receptor CD33 váže. Jenže který konkrétní sialoglykoprotein?
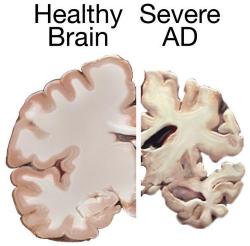
Vědci, ve snaze ho přesně určit, zkoumali mozkovou tkáň pěti lidí, kteří zemřeli na Alzheimerovu nemoc a dalších pěti, kteří v podobném věku skonali z jiných příčin. Zjistili, že pouze jeden glykoprotein dokáže vybudit CD33 k aktivitě, a tedy omezit čistící schopnost mikroglií. U jeho polysacharidové složky (glykanu) krok za krokem určili druh a pořadí jejich stavebních bloků a identifikovali ji jako sialylovaný keratan sulfát.
Poté se zaměřili na bílkovinovou část molekuly a pomocí hmotnostní spektroskopie stanovili pořadí jejich jednotlivých aminokyselin. Výsledek této analýzy zněl: receptorová tyrosin fosfatáza zeta (RPTPζ).
Vědci pak celou kombinovanou glykoproteinovou strukturu – keratan sulfát + tyrosin fosfatáza zeta – jako celek označili zkratkou RPTPζ S3L.
„Došli jsme k závěru, že (glykoprotein) RPTPζ S3L je distribuován v mezibuněčné hmotě lidského mozkového parenchymu, kde se zapojuje do činnosti mikroglií,“ píší ve své studii.
Tím ale jejich zájem nekončí. Za cíl si kladou rozluštění podrobné struktury RPTPζ S3L a pochopení celého mechanismus aktivace mikrogliového receptoru CD33. Kdyby se ho podařilo do potřebné míry vyřadit z činnosti, pacientům s Alzheimerem by to s velkou pravděpodobností zlepšilo kognitivní schopnosti a zpomalilo postup nemoci, jak naznačují jiné výzkumy na laboratorních hlodavcích s genetickou predispozicí k obdobě nejčastější lidské neurologické degenerace.
Literatura
Johns Hopkins University School of Medicine; Journal of Biological Chemistry.
Video: Mikroglie; Fyziologie nervového systému - Khan Academy Kredit: Matthew Barry Jensen.
Video: Názorné vysvětlení jak Alzheimerova choroba mění mozek Kredit: National Institute on Aging
Video 3: Seznamte se s mikrogliemi: přehlížení superhrdinové vašeho mozku (anglicky).
Kolik stojí demence?
Autor: Josef Pazdera (23.08.2017)
Na demenci ultrazvukem?
Autor: Dagmar Gregorová (22.07.2018)
Neuritóza není neuróza
Autor: Josef Pazdera (29.12.2018)
Dementní mozek se podařilo zotavit dodáním kmenových buněk
Autor: Josef Pazdera (29.04.2021)
Totální válka v mozku: Je Alzheimerova nemoc důsledkem infekce?
Autor: Tomáš Petrásek (27.03.2022)
Diskuze: