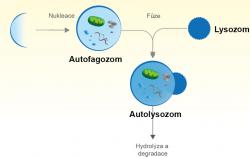
21. ledna časopis Neuron zveřejnil článek, v němž tým vědců převážně z Yaleovy univerzity v americkém státě Connecticut odhalil, že klíčovým koordinátorem buněčné úklidové čety je protein ATG-9 (autofágní protein 9A). Vstupuje nejen do synaptických procesů, ale také signalizuje potřebu zvýšené autofagie (z řečtiny sebe-pojídání), při níž jsou pohlceny a na základní stavebné molekuly degradovány poškozené bílkoviny nebo buněčné organely.
"Neurony jsou často aktivní a jejich mechanismy podléhají opotřebení," vysvětluje vedoucí týmu, Daniel Colón-Ramos, docent na Katedře buněčné biologie a Katedře neurověd Lékařské fakulty Yaleovy univerzity.

Čím aktivnější tyto neurony jsou, tím naléhavěji se musí zbavovat poškozených buněčných komponent – například abnormálních proteinú nebo nefunkčních organel. Tyto jsou nejdříve uzavřeny do váčků – autofagozomů, které plní funkci buněčných popelářských vozů. Odváží odpadní buněčné trosky k povrchové membráně, kde se včlení do sférických organel – lysozomů. Ve výsledných autolysozomech enzymy – hydrolázy – autofagozomy včetně buněčného smetí degradují (hydrolyzují) na stavební jednotky. Ty pak buňka opět využije na tvorbu nových struktur. Ukázková recyklace. Zmíněný systém odvozu a zpracování odpadu v neuronech musí být ale nějak načasovaný a koordinovaný. A právě na tyto řídící mechanismy si vědci posvítili – a to hodně zblízka.
Zajímali se zejména o funkci zmíněného autofágního proteinu ATG-9, který pozorovali v blízkosti neuronálních synapsí. Pomocí geneticko-molekulárních postupů zjistili, že ATG-9 sleduje aktivitu neuronů tím, že prochází procesem zvaným synaptický vezikulární cyklus, při němž buňky vylučují neurotransmitery zprostředkující důležité mozkové funkce. Zjistili, že když se synaptická aktivita zvyšuje, zvyšuje se i cyklus synaptických vezikul, a tedy i využití ATG-9. Signál, že krizová uklízecí četa má pohotovost. Životně důležitá autofagie tak nabírá na obrátkách.
"Myslíme si, že když neurony vykonávají svou funkci a přenášejí informace, autofágní protein 9 funguje jako snímač aktivity, který při zvýšení činnosti neuronů pomáhá upozornit buňky, aby rozběhly velký úklid," vysvětluje první autorka studie, doktorandka Sisi Yangová. "ATG-9 tedy působí jako koordinátor synaptické aktivity a autofagie."
Tyto poznatky přispívají k pochopení základní patologie neurodegenerativních onemocnění, která jsou spojována s narušeným procesem autofagie. Autoři kromě jiného zjistili, že několik mutací souvisejících se synaptickou aktivitou – včetně jedné genetické mutace identifikované u lidí s Parkinsonovou chorobou – ovlivňuje působení ATG-9 v synapsích. V důsledku toho při větší aktivitě neuronů nedojde ke zvýšené autofagii a nervové buňky se zahlcují nefunkčními komponenty.
"Skutečnost, že tytéž genetické změny souvisí s neurodegenerativními poruchami, nyní poskytuje terapeutické cíle pro reaktivaci těchto uklízecích procesů. Mohlo by se tím předejít neuronální dysfunkci pozorované u neurodegenerativních nemocí", sumarizuje důležitý význam studie Daniel Colón-Ramos.
Video: Japonský biolog Yoshinori Ohsumi obdržel v roce 2016 za odhalení mechanismů autofagie Nobelovu cenu za fyziologii a medicínu. Stručné názorné vysvětlení autofagie:
Diskuze: