Rozmanité podvodní stroje a zařízení, robotické ponorky nebo třeba podvodní detektory často samostatně operují pod vodní hladinou po velmi dlouhou dobu. Aby to mohli zvládnout, tak k tomu potřebují vlastní a pokud možno spolehlivý zdroj energie. Mohou to být baterie, palivové články nebo třeba zařízení, které si samo obstará energii v okolním prostředí.
Liang Tang, Hu Jiang, a Ming Hu vedli tým složený z badatelů čínských univerzit, který vyvinul převratný systém pro získávání energie z mořské vody. Jde o levné zařízení pro přímou elektrochemickou extrakci energie z mořské vody, které se dovede autonomně přepínat podle nároků na energii. Dokáže zajistit nepřetržité dodávání stabilního množství energie, a v případě potřeby se přepne do módu, v němž zvládne krátkodobé návaly požadavků na velký výkon.
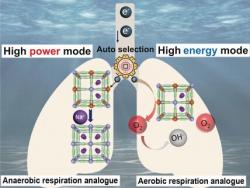
Podvodní roboti a podobná zařízení dnes mapují mořské dno, proudy či teploty v oceánu, monitorují a opravují podmořská potrubí a kabely, a také dělají v oceánu spoustu dalších náročných věcí, většinou do značné míry autonomně. Náročná práce v extrémních podmínkách obvykle vyžaduje zdroje energie s vysokou hustotou energie (high energy density), které mohou dodávat stálé množství energie pro základní provoz po dlouhou dobu, a zároveň zdroje s vysokou hustotou výkonu (high power density), které poslouží při náhlém požadavku velkého výkonu.
Čínský tým se inspiroval u mořských organismů, které mohou přepínat metabolismus jejich buněk mezi aerobním a anaerobním módem tím, že používají různé materiály v roli příjemce (akceptoru elektronů). Badatelé vyvinuli zdroj energie, který pracuje na podobném principu. Zařízení využívá pozoruhodné materiály kovové organické kostry MOF (Metal-Organic Frameworks). Klíčovým prvkem zařízení je katoda z pařížské (berlínské či také pruské) modři, což je chemicky ferrokyanid železitý, která spolupracuje s kovovou anodou při získávání elektřiny z mořské vody.
Když zařízení dodává energii v režimu pro základní provoz, tak jsou elektrony proudící ke katodě předávány kyslíku rozpuštěnému v mořské vodě. Zásoba kyslíku v mořské vodě je prakticky nevyčerpatelná, takže by zařízení v základním režimu mohlo teoreticky fungovat navěky. Problém je v tom, že rozpuštěného kyslíku je v mořské vodě málo. Když se náhle zvýší požadavky na energii, tak na katodě zařízení není dost kyslíku, který by přijal všechny přicházející elektrony. Katoda z pařížské modři musí takové elektrony uskladnit, což udělá tak, že redukuje atomy železa z Fe 3+ na Fe 2+. Aby zařízení udrželo rovnováhu elektrického náboje, tak musí v krátkém čase absorbovat velké množství iontů sodíku. Jakmile se nároky na energii zase sníží, tak se železo opět oxiduje, ionty sodíku se uvolní do okolní mořské vody a vše se vrátí k normálu.
Nový systém je velice stabilní a z koroze mořskou vodou si mnoho nedělá. Vše rovněž nasvědčuje tomu, že vydrží mnoho cyklů přepnutí mezi módy základního provozu a velkého výkonu. Testy ukazují, že zařízení může v módu velkého výkonu bez potíží běžet nepřetržitě 4 dny. V tomto módu systém dodává potřebnou energii pro 39 LEDek a vrtuli.
Literatura
Wiley Online 13. 5. 2019, Angewandte Chemie online 29. 3. 2019.
Zázrak jménem MOF: Zařízení na solární pohon vyždímá vodu ze vzduchu
Autor: Stanislav Mihulka (19.04.2017)
Baterie, co dýchá vzduch, by se mohla stát ultralevným úložištěm energie
Autor: Stanislav Mihulka (20.10.2017)
Poloumělá fotosyntéza kombinuje sílu přírody s důmyslnou chemií
Autor: Stanislav Mihulka (06.09.2018)
Diskuze:
Šírá hláď vodní do dáli rozlitá. Stříbrná volavka marně tam krouží nad ztracennou Mg elektrodou 3x3 cm.
Josef Hrncirik,2019-05-16 10:37:40
Kombinace německé důkladnosti v Angewandte Chemie a pracovitosti 10 čínskách vědců umožňuje ihned zjistit, že vždy kombinovali bohatýrské anody 3x3 cm s chabými plíčky 1x1 cm
Josef Hrncirik,2019-05-16 12:55:05
Tloušťky se jim před editory podařilo zatajit. V zásadě je to jedno, protože mořská voda má jen cca 6 mg volného kyslíku/litr. Ten by stačil k oxidaci (ztracení) 7 mg Al, 9 Mg, 24 Zn nebo k regeneraci cca 225 mg modře. K tomu by však plíce 1 cm2 musely být v režimu proudění. Teoreticky systém Mg + 1/2 O2 = MgO dá 3,2 V. Z 6 mg kyslíku to dá 48 C to je 154 J. Ve skutečnosti jim Mg dávalo max. napětí jen 1,2 V klesající při odběru i na 0,6 V. Neschopnost článku dodávat proud však nazvali autoswitching napětí. Při výrobě katody potřeli 1cm2 karbonového papíru směsí modři, sazí, PVDF v metylpyrolidonu bez gramáží a tlouštěk. V mořské vodě s kyslíkem se jim anody budou ztrácet před očima i bez odběru proudu korozí. Difuzní bariéry by zvýšili i tak velký odpor článku s pouhou mořskou vodou. Pokud anody nebudou v prostředí rozpouštějícím oxid vzniklý odběrem proudu či korozí, proud se brzy zmenší až zastaví. V takovém prostředí se však kov může rozpouštět za vzniku H2 bez proudu zátěží.
Nejde o podvodný článek o podvodním článku, vše je naprosto jasné od samotného začátku.
Kofucius se řehtá jak Čínský Bůch Srandy.
Nevšiml si ale, že lstiví germáni to vydali již 29. března.
Po krátkém waterboadingu mořekou vodou Mrtvého Moře pruská modž přiznala barvu v 10.1002/anie.201901759
Josef Hrncirik,2019-05-15 12:40:25
Jde o známý trik s obětováním anody.
Jako obětované ztracené anody byly Neptunovi obětovány čerstvé Mg, Al, Zn anody.
Nejrychleji požíral anody Mg, Zn. Bez těch zatracených ztracených anod Vám Neptun neprotlačí obvodem ani e-.
Článek s Mg pak místo teoretických cca 3 V dává jen cca 1,2 V při 10 uW/cm2 (pruských plic na O2) či až 100 mW/cm2 ale při jen 1 V; prusové pod vodou již nestačí lokat po kyslíku). Tyto nicneříkající údaje jsou asi mnohem optimystičtější než technicky zajímavější kW či kWh /l či kg.
Stejně to zkoušeli v provozu jen 100 hodin.
Pěkné
Radovan Slegl,2019-05-15 08:07:38
Pěkné, ale zatím to zní moc zázračně. Bylo by pěkné, kdyby z toho něco bylo.
Re: Pěkné
Alexandr Kostka,2019-05-15 08:47:04
I mě se to nezdá. A to jsem si pročetl zdroj. Mluví o absorbci elektronů, přičemž nikde neříkají z čeho. Volné elektrony se nepřekvapivě v mořské vodě nenachází, takže vysvětlení je přinejmenším nepřesné. Nepatrně sdílnější jsou ohledně druhé varianty, bez kyslíku, kdy se mají na atomy železa vázat ionty sodíku, jenže.. Sodík v možské vodě rozhodně není ve formě rozpuštěných iontů. (ostatně ani nikde jinde) Sodík je v moři vázaný na chlor. NaCl, běžná sůl. A ta vazba je dost pevná, její roztržení je energeticky velmi náročné. Nějak se mi nezdá, že by jí šlo přebít jinou, "lepší" za podmínky, že by to ještě poskytlo energii. Natož, že by takový proces byl vratný. I když, čert ví co dokáže správný katalyzátor. Jak říkám, zdroj zcela postrádá jakékoliv detaily.
Re: Re: Pěkné
Florian Stanislav,2019-05-15 10:52:31
Píšete :"Sodík v možské vodě rozhodně není ve formě rozpuštěných iontů. (ostatně ani nikde jinde) Sodík je v moři vázaný na chlor. NaCl, běžná sůl. A ta vazba je dost pevná, její roztržení je energeticky velmi náročné."
Komentář: Těžko. Mořská voda je roztok iontů (nejvíce Na+ a Cl-), ionty jsou obklopeny polárními molekulami vody ( solvatace iontů). Osolení polévky není energeticky náročná jako elektrolýza.
Berlínská modř:
http://www.piskac.cz/pavel/recenze/TIS/FERROKYANID%20ZELEZITY.RTF
Celkově snad. Zdroj + spotřebič (podmořský robot) tvoří systém, který musí mít celký zdroj energie jako přeba fotovoltaické články ze slunce. Zdrojem energie je oxidace kyslíkem, kyslík sám se redukuje (přijímá elektrony). Elektrony při zatížení proudí přes kyslík do mořské vody asi jako u stejnosměrné lokomotivy se vrací skrz Zemi elektrony ke zroji (elektrický proud je uspořádaný tok elektronů). Při velkém odběru z robotů se uskladní elektrony do rekukce Fe3+ na Fe2+. No dobře, ale co je zoxiduje zpátky na Fe3+, když to musí být s dodáním energie (ta se při odběru robotem odebrala) ? Oxidace je odštěpení elektronů, tedy přijem iontu Na+ je zmenšení množství volých elektronů. Ionty Na+ tam může nahnat snad osmotický tlak? Co Na+ vyžene ven?
Působí to lehce perpetuummobilně.
Re: Re: Re: Pěkné
Alexandr Kostka,2019-05-15 21:17:25
Perpetuum mobile a nezdá se mi to ani prostou logikou. Pokud yb bylo pro sodík energeticky výhodné rozvázat vazbu s chlorem a navázat novou s kyslíkem, kolik by bylo v mořské vodě chloridu a kolik oxidu?
I kdyby reakce samovolně probíhala nesmírně pomalu, moře existují opravdu dlouho a též dost dlouho je nad nimi kyslíková atmosféra a ve vodě kyslík.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce