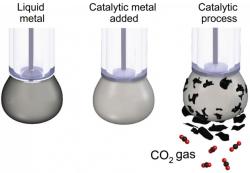
Mnozí naříkají nad tím, že spalujeme fosilní suroviny a uvolňujeme z nich oxid uhličitý. Ten je sice fajn, protože udržuje naši planetu nezmrzlou, jenomže všeho moc škodí. Co kdybychom ale tenhle technologický krok doslova obrátili? A vyráběli z nadbytečného oxidu uhličitého uhlí?
Zní to rozverně, ale přesně tohle dělá výzkumný tým, který vedou lidé z australské techniky RMIT v Mebourne. Používají katalyzátor z kapalného kovu a s jeho pomocí efektivně vyrábějí z plynného oxidu uhličitého pevné částice uhlíku. Jde o zásadní průlom, který by mohl změnit soudobé technologie ukládání uhlíku. Jejich výzkum publikoval časopis Nature Communications.
Dnešní průmyslové technologie ukládání uhlíku se obvykle spoléhají na stlačování oxidu uhličitého do podoby kapaliny, která je následně transportována na úložiště, kde skončí pod zemí. Jak se ale dalo očekávat, tyto technologie doprovázejí problémy. Jednak nejsou příliš ekonomicky životaschopné a zároveň panují obavy o důsledky případných úniků oxidu uhličitého z takových úložišť.
Torben Daeneke a jeho spolupracovníci jsou přesvědčeni, že přeměna oxidu uhličitého na uhlí by mohla fungovat lépe. Daeneke s lítostí připouští, že zatím neumějí z oxidu uhličitého vytvořit plnohodnotné uhlí a vrátit ho pod zem. Ale tím, co už dovedou, vlastně přetáčejí „emisní“ hodiny proti tradičnímu směru jejich hodinových ručiček.
Podle Daenekeho až doposud technologie přeměny oxidu uhličitého na pevný uhlík zahrnovaly extrémně vysoké teploty, čímž bylo jejich průmyslové využití finančně nepraktické. Když ale Daeneke s kolegy použili jako katalyzátor kapalné kovy s nanočásticemi vytvořenými z prvku ceru, tak se jim povedlo vyrobit pevný uhlík z plynného oxidu uhličitého za pokojové teploty. Tím pádem tenhle proces dostává vstupenku do průmyslové výroby, i když ještě zbývá udělat spoustu výzkumu a vývoje.
Jak to funguje? Badatelé vyvinuli katalyzátor z kapalného kovu s cerovými nanočásticemi, který má specifický povrch. Velmi účinně vede elektrický proud a jeho povrch se přitom chemicky aktivuje. Oxid uhličitý je rozpouštěný v nádrži s kapalným elektrolytem, k němuž je přimíchané malé množství zmíněného kapalného kovu. Do této směsi se následně pouští elektrický proud. Oxid uhličitý se poté pomalu přeměňuje na vločky pevného uhlíku, které se postupně odlupují od povrchu kapalného kovu.
Tímto postupem může probíhat nepřetržitá produkce vloček „uhlí“. Podle badatelů je možné takto vyrobený uhlík používat jako výkonnou elektrodu. Technologie zuhelnění oxidu uhličitého vytváří uhlík, který je schopný pojmout elektrický náboj. S trochou snahy by se takový uhlík mohl uplatnit například při výrobě budoucích elektromobilů a podobných strojů. Zároveň jako vedlejší produkt vzniká palivo, které by rovněž mohlo nalézt praktické uplatnění.
Video: Turning carbon dioxide back into coal | RMIT University
Literatura
RMIT University 27. 2. 2019, Nature Communications 10: 865.
Průlomový solární článek vyrábí palivo z oxidu uhličitého a slunečního záření
Autor: Stanislav Mihulka (02.08.2016)
Nová důmyslná molekula recykluje oxid uhličitý z atmosféry jako divá
Autor: Stanislav Mihulka (18.03.2017)
Nový pevný katalyzátor exceluje v rozkládání vody na vodík a kyslík
Autor: Stanislav Mihulka (03.08.2017)
Katalyzátor z nanomědi recykluje oxid uhličitý na ethen
Autor: Stanislav Mihulka (18.01.2018)
Důmyslně zrychlená výroba magnezitu umožní dlouhodobé ukládání CO2
Autor: Stanislav Mihulka (18.08.2018)
Nová lithiová baterie pohlcuje oxid uhličitý a vyrábí karbonát
Autor: Stanislav Mihulka (01.10.2018)
Diskuze:
Osle!!!
Michal Lichvár,2019-03-12 22:20:56
Pane Mihulko ... uvedomujete si, aký energetický nezmysel je tento "vynález" a že jeho nekritickou propagáciou len zhoršuje znečistenie tejto planéty?
13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Josef Hrncirik,2019-03-12 07:36:58
Redukce prý nastává při pokojové teplotě při přepětí pouhých 0,31 V oproti vratné elektrodě CO2/C na povrchu kapalného kovu, který pochopitelně nemá katalytický účinek a povrch, který by se mohl deaktivovat či zapéct.
Současně však tvrdí, že reakce probíhá katalyticky na nanočásticích ceru na povrchu kapky jeho suspenze v kapalném kovu. Přitom se na tuhém povrchu ceru aktivovaném napětím při elektrolýze uvolňuje cca 90% ní uhlík. Cer se však nutně oxiduje na Ce2O3 a touto elektrolýzou jej nelze in situ zpět recyklovat (to pochopitelně nepíší) a k delší reakci se musí zoxidovat nové částice Ce z nitra suspenze. Ze slučovacího tepla Ce2O3 plyne, že potřebné napětí k jeho elektrolytické regeneraci je min. 0,75 V. A najednou je nutné přepětí proti poněkud nejasné nebohé CO2/C eldě min. 1,06 V. Cer je nutno regenerovat z oxidu převedením na tavitelnější chlorid elektrolýzou nikoliv při pokojové teplotě, alebrž při b.t. Ce cca 800°C . Nutné přepětí nelze zdarma vyhledat, ale pro celou reakci anodu i katodu dělá určitě 2-3 V jako u běžných výrob Al či Mg.
A najednou máme přepětí min. 3,06 V. Jejich kapalná kovová katoda používala jako anodu nepolarizovatelnou elektrodu Ag+/Ag. Při praktické elektrolýze při vylučování O2 by však museli překonat přepětí min. 0,5 V a tak by nutné přepětí pro technický děj bylo min. cca 3,56 V. Z Gibbsovy energie redukce CO2/C 394 kJ/mol je rozkladné napětí CO2 1,02 V.
Připravený uhlík byl však z cca 5% naoxidován.
Energetická účinnost navržené regenerace CO2/C potom nebude větší než 0,95x1,02/(3,06+1,02)= 0,24 = 24%.
To nejspíš má i redukce CO2 elektrolytickým H2 petrochemicky na Ni na CH4 a jeho další převedení na saze. Při elektrolýzách je největší přepětí při nutném uvolňování kyslíku.
Re: 13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Michal Lichvár,2019-03-13 09:06:10
Dobrý deň
prosím Vás, odkiaľ máte tých 800 stupňov? Handrkujem sa v diskusií na FB a chcem niečím podporiť Váš názor ... v článku som našiel ale len:
"Due to the applied reductive potential, the CeO2 was continuously reduced back to elemental Ce which drove the catalytic process. This correlates with the principle of the incipient hydrous oxide adatom mediator (IHOAM) model of electrocatalysis29. The process can be described by the chemical reactions 1–5. Reactions 1–4 are proposed to occur at the working electrode (Fig. 3), with reaction 5 describing the oxygen evolution reaction at the counter electrode."
https://www.nature.com/articles/s41467-019-08824-8
Re: Re: 13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Josef Hrncirik,2019-03-13 20:29:55
Cer nelze vyrobit elektrolýzou vodných roztoků jeho solí či dokonce nerozpustných, obtížně tajících, velmi stabilních (a nevodivých) oxidů. Je to stejně marné jako se takto pokoušet vyredukovat Mg či Al. Místo toho se vylučuje H2. Ce se zato také skutečně ve vodě samovolně oxiduje a uvolňuje H2 za vzniku Ce2O3.
Proto se pochopitelně vyrábí podobně jako Mg elektrolýzou z taveniny směsi chloridů Ce a chloridů alkalických kovů.
Kysličník CeO2 má b.t. 2600°C a je to známý žáruvzdorný materiál výše tající než korund (Al2O3). Ce2O3 se zapálí při 200°C a má b.t. 1700°C. Převést je do taveniny a provádět elektrolýzu v kryolithové tavenině je zřejmě obtížnější než pro hliník a proto je cer vždy vyráběn elektrolýzou taveniny chloridů, přestože je to komplikováno nutností připravit jeho chloridy a vznikem obtížného chloru při elektrolýze.
Ce taje při cca 800°C. získat taveninu a kontinuálně ji odvádět je výhoda. Určitě se pokoušeli připravit ho jednoduše z vodných roztoků či dokonce nesmyslně ze suspenze oxidu.
Na webu se uvádí jen prakticky využívaný potenciál Ce4+ +e- = Ce3+ 1,61 V;
platí jen pro vodné prostředí (s vydatnou tvorbou komplexů).
Ce4+ se používají jako silné snadno (elektrolyticky) recyklovatelné oxidovadlo.
Ce3+ v roztoku pochopitelně však není silné redukovadlo, již nepatrné množství vzniklého Ce4+ systém posune do oblasti oxidovadla.
Vodný systém Zn/Zn++ v kombinaci s jednofázovým (roztok) Ce++++/Ce+++ je zajímavý jako průtočný aku s nejvyšším použitelným napětím cca ?2,45 V. Přesto však již probíhají parazitní reakce vzniku H2 rozpouštěním Zn i bez odběru proudu a podobně samovolnou redukcí Ce4+ na Ce3+ uvolněním O2 z vodného roztoku. Energetická účinnost tripu je pak jen 70%. Prostě příliš silná oxidovadla i redukovadla reagují i s vodou a extrémní se ve vodě nedaří připravit. To by pak v baterii nemuseli mít Zn, ale redukcí Ce3+ by získali Ce a větší napětí než pro Zn při jednoduší chemii .
Zřejmě to nejde ani málo jako u Mg i Al.
Poznámku "Due to the applied potential … " jsem pochopitelně v článku četl a podtrhl si ji. Brzy odpovím.
Re: Re: Re: 13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Michal Lichvár,2019-03-14 10:30:08
Musím sa priznať, nerozumiem :)
len ma prekvapilo, ak je to také energicky náročné získať Ce, prečo sa jeho cena na trhoch taká nízka ... veď tá cena by mala reflektovať aj energetickú náročnosť na jeho výrobu.
Re: Re: Re: Re: 13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Josef Hrncirik,2019-03-15 08:04:49
Cena kovu jen poměrně málo souvisí e energií nutnou k jeho vyredukování elektrolýzou.
Našel jsem burzovní ceny a přepočítal je na K,-/kg v kovu či ev. v oxidu.
Na 76,-; přitom sůl je skoro zadarmo. Mg 70; Al 49; ale v Al2O3 jen 15; Ce 125; v CeO2 74; Ha ha ha Li 2640; v karbonátu 1432.
Asi platí princip šábneme se napolovic.
Na samotnou elektrolýzu pro přípravu 1 kg Li (pochopitelně z jednoduše připraveného LiCl z karbonátu) padne jen! cca 15 kWh a pochopitelně jen cca 10 kWh lze pak vydobít z dobitého liona z 1 kg Li oxidací jeho anody.
Re: Re: Re: Re: Re: 13 australských vědců vědecky zatemnilo nevýhodnost redukce CO2 na tuhý uhlík na kapalném kovu s nanočásticemi ceru
Michal Lichvár,2019-03-16 23:24:06
"cca 15 kWh a pochopitelně jen cca 10 kWh lze pak vydobít z dobitého liona z 1 kg Li oxidací jeho anody."
za celú dobu životnosti batérie?
.
Novák Jiří,2019-03-02 00:10:20
Takto podané je to samozřejmě blbost. Ale pokud chceme trvalou základnu na Měsíci nebo Marsu, tak se bez něčeho podobného asi neobejdeme.
Super
Jaroslav Lepka,2019-03-01 12:58:17
a zákon zachování energie tiše pláče nad promarněnou šancí.
Re: Super
Jan Poslušný,2019-03-01 15:18:35
Přesně tak, ale ten se asi na žurnalistických fakultách neprobírá.
A není to sprosté?
Jiří Pospíšil,2019-03-01 06:33:44
Takhle brát kvůli svým idejím, že CO2 je jedovaté, drahou výrobou uhlí, brát rostlinkám žrádlo?
Proč
Pavel Krušina,2019-02-28 15:45:36
A nebylo by jednodušší a energeticky výhodnější to vytěžené uhlí prostě nespalovat?
Perpetum mobile
Jan Kavalír,2019-02-28 15:39:44
A nebo spíš pěkná ptákovina, kterou se vědci dobře pobavili, pokud ji prezentovali jako způsob ukládání uhlíku. Pokud tedy ten vyrobený uhlík nemá nějaké speciální vlastnosti, např. pro zmiňované elektrody.
Re: Perpetum mobile
Vojta Ondříček,2019-02-28 16:18:27
Pravda, v nadpisu článku se píše, že kráčí o zábavu.
Na redukci uhlíku z kysličníku uhlíku je v idealizovaném principu potřeba stejná energie, jako byla uvolněná oxidací uhlíku. V praxi je možná potřeba tuna uhlí na energii potřebnou k získání několika gramů uhlíku z kouře té tuny uhlí.
Když se ti vynálezci pořádně obují do problému, tak mohou dělat z CO2 pro zábavu diamanty a tím tu zábavu financovat. A když ne diamanty, tak aspoň tuhy do tužek. :-)
Re: Re: Perpetum mobile
Jiri Naxera,2019-03-02 02:03:16
Tak malinko si rejpnu do našich solárních baronů, ale pokud by neexistovaly nesmyslné povinné dotace solárů a 1kWh z nich by odpovídala tržní hodnotě (jestli jsou celkové náklady na stabilní proud z jádra někde kolem koruny, tak v řádu desítek haléřů max) tak myslím že i nepříliš účinná akumulace do umělého uhlí (nebo do vodíku nebo radši metanu nebo čehokoli co se dá ve velkém množství skladovat a ideálně lejt do aut aspoň než budou lepší baterky) by dávala celkem smysl.
Re: Re: Re: Perpetum mobile
Alexandr Kostka,2019-03-04 01:28:36
Když je energie, dá se dost snadno vyrábět metan. Nic víc není potřeba dělat, metan stlačený v nádrži se nazývá CNG a atuo na něj jede naprosto v pohodě.
Re: Perpetum mobile
Petr Petr,2019-02-28 18:38:15
Oni žijí v představě, kde hlavní roli hraje CO2 v atmosféře (nikoli absolutně všude). Tj. ukládání CO2 pomocí elektřiny. Samozřejmě ne získané fosilně. Já bych nepočítal ani biopaliva, protože nahrazovat přirozené vázání uhlíku rostlinami vázáním zprostředkovaným je neefektivní. Oni pravděpodobně uvažují, že větrné a solární elektrárny vyrobí elektřinu navíc, která se nespotřebuje, a tou převedou CO2 na uhlí. Ovšem na to bude asi vždy málo energie... Přirozené ukládání rostlinami a do oceánů lidskými kapacitami nedoženeme.
Diskuze je otevřená pouze 7dní od zvěřejnění příspěvku nebo na povolení redakce